Versuche zur Vorlesung Allgemeine Chemie I
Wasserstoff herstellen und pneumatisch auffangen

Im Video wird gezeigt, wie Wasserstoff durch Reaktion von Zinkgranalien mit Salzsäure hergestellt und anschließend pneumatisch aufgefangen wird. Eine (negative) Knallgasprobe zum Nachweis des Gases schließt das Video ab.
Naszierender Wasserstoff

Im Video wird Wasserstoff durch Reaktion von Eisenwolle mit Salzsäure hergestellt. Der entstandene Wasserstoff wird per Knallgasprobe geprüft bis diese reinen Wasserstoff indiziert. Der Wasserstoff wird in eine Methylenblau-Lösung eingeleitet. Zum Vergleich wird Methylenblau-Lösung direkt zum Reaktionsgemisch gegeben.
Anschließend werden weitere Versuche durchgeführt: Wasser und Salzsäure werden mit Methylenblau versetzt. Die Salzsäure-Lösung wird zu etwas Eisenwolle gegeben und in die Lösung werden weitere Tropfen einer Methylenblau-Lösung gegeben. Zum Vergleich wird Eisenwolle in die wässrige Lösung gegeben.
Wasserstoffballons

Im Video werden verschiedene Explosionsgemische, basierend auf Wasserstoff, gezeigt.
Die Kalkwasserprobe

Im Video wird die Kalkwasserprobe demonstriert: Im ersten Teil wird Kohlenstoffdioxid aus einer Gasflasche in Kalkwasser eingeleitet. Im zweiten Teil wird Atemluft in Kalkwasser eingeleitet.
Verbrennung von Wasserstoff im Vergleich zu der von Isobuten

Es werden Wasserstoff und Isobuten verbrannt und verschiedene Nachweisversuche der Verbrennungsgase durchgeführt.
Entzünden von Wasserstoff mithilfe eines Platinkatalysators

Im Video werden Wasserstoff hergestellt, mehrere Knallgasproben durchgeführt und anschließend Wasserstoff entzündet – mit einem Feuerzeug und später mithilfe eines Katalysators.
Reaktion mit Salzsäure: Vergleich zwischen Zinkpulver und Zinkgranalien

Im Video werden etwa die gleiche Menge Zinkpulver bzw. Zinkgranalien jeweils mit halb konz. Salzsäure versetzt. Die Heftigkeit der Reaktionen wird miteinander verglichen: Einmal direkt, und einmal indirekt durch die Menge an Wasserstoffgas, die entsteht (Größe der Flamme)
Hofmann'scher Wasserzersetzungsapparat

Im Video wird angesäuertes Wasser elektrolysiert und die entstandenen Gase werden mit den entsprechenden Nachweisen nachgewiesen.
Low-Cost-Brennstoffzelle, Teil 1
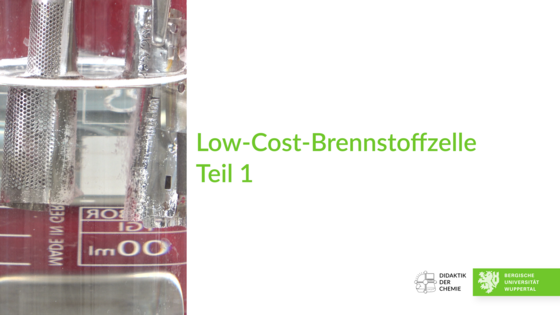
In einem Low-Cost-Aufbau, bestehend aus zwei Rasierscherfolien und einer Kaliumhydroxid-Lösung werden durch Elektrolyse Wasserstoff und Sauerstoff hergestellt. Die Bildung von Gasblasen an beiden Folien wird gezeigt. Anschließend wird mit dieser Zelle ein Motor betrieben.
Low-Cost-Brennstoffzelle, Teil 2

Die Apparatur, bestehend aus einem Becherglas mit zwei Rasierscherfolien, einer Solarzelle und einem Elektromotor, wird erkundet. Anschließend wird Kaliumhydroxid-Lösung in das Becherglas eingefüllt und die Solarzelle mithilfe einer Lampe bestrahlt. Der Motor dreht sich und es wird die Entstehung von Gasblasen an beiden Elektroden gezeigt. Sobald die Lampe ausgeschaltet wird, dreht sich der Motor noch eine Weile weiter. Dies wird hervorgehoben, indem im anschließenden Teil im zweigeteilten Bildschirm die Dauer des nachlaufenden Motors mit und ohne angeschlossener Low-Cost-Brennstoffzelle verglichen wird.
Alkalimetalle: Natrium

Im Video werden: - der metallische Glanz von frisch angeschnittenem Natrium - die elektrische Leitfähigkeit von Natrium - die Reaktion von Natrium mit Wasser und - das Eindampfen der Reaktionslösung von Natrium mit Wasser gezeigt.
Alkalimetalle: Lithium

Im Video werden: - der metallische Glanz von frisch angeschnittenem Lithium - die elektrische Leitfähigkeit von Lithium und - die Reaktion von Lithium mit Wasser gezeigt.
Vergleich zwischen Natrium und Lithium

Im Video wird die Leitfähigkeit der Metalle Lithium und Natrium demonstriert.
Reaktion mit Wasser: Lithium, Natrium und Kalium

Im Video werden zuerst der metallische Glanz sowie die Schneidfestigkeit der Alkalimetalle Lithium, Natrium und Kalium gezeigt. Anschließend werden diese in eine Wanne mit Wasser gegeben, um die Reaktivitäten zu vergleichen.
Flammenfärbungen

Im Video werden die Flammenfärbungen eines Lithium-, eines Calcium- und eines Natriumsalzes gezeigt.
Erdalkalimetallversuche: Calcium und Magnesium

Im Video wird die Reaktion von (metallischem) Magnesium bzw. Calcium mit Wasser gezeigt sowie später die Verbrennung beider Metalle.
Sublimation von Iod

In dem Video werden Iod-Kristalle in einen Erlenmeyer-Kolben gegeben und die Öffnung mit einem Uhrglas abgedeckt. Der Kolben wird anschließend auf einer Heizplatte auf 100°C erhitzt und die Beobachtung im Zeitraffer gezeigt.
Diffusion von Brom

Ein kleiner Standzylinder wird mit Bromdämpfen gefüllt, ohne dass flüssiges Brom mit in den Zylinder kommt. Der Zylinder wird mit einem Abdeckglas verschlossen und ein zweiter Standzylinder wird umgekehrt über den ersten gesetzt.
Das Abdeckglas zwischen beiden Zylindern wird entfernt und die Zylinder werden sofort aufeinander gepresst. Die Abläufe werden für einige Zeit beobachtet.
Synthese von Natriumchlorid aus den Elementen

Im Video wird zuerst Chlor hergestellt. Dafür wird der Stempel einer 100-mL-Plastikspritze entfernt und es werden ca. 0,4 g Calciumhypochlorit in der Spritze abgewogen. Der Stempel wird wieder eingesetzt und so weit in die Sprizte gedrückt, dass das Calciumhypochlorit auf einer Seite der Spritze eingeklemmt wird. Die Spritze wird gedreht, so dass das Calciumhypochlorit oben ist, dann werden ein Becherglas mit konz. Salzsäure und die Spritze schräg gehalten und es werden ca. 0,5 mL Salzsäure in die Spritze gezogen. (1 mL ist auch nicht schlimm.) Die Spritze wird mit einem Stopfen verschlossen und dann so gedreht, dass die Salzsäure mit dem Calciumhypochlorit reagieren kann. Auf diese Weise können direkt 50 – 60 mL Chlorgas direkt in der Spritze hergestellt werden. Vor benutzung des Gases empfiehlt es sich, die Öffnung der Spritze nach unten zu halten und noch vorhandene Flüssigkeit herauszudrücken. Vorsicht, in der Spritze ist ein leichter überdruck, daher empfiehlt es sich den Stopfen mit Handschuhen zu entfernen.
In einem schwer schmelzbaren Reagenzglas wird ein entrindetes, erbsengroßes Stück Natrium geschmolzen, dann wird aus einer Spritze Chlorgas auf das Natrium geleitet.
Synthese von Natriumchlorid aus den Elementen – langsam

Im Video wird Chlor hergestellt zu einem Stück Natrium gegeben. Das Chlorgas reagiert langsam mit dem Stück Natrium und es bildet sich eine weiße Salzkruste. In den anschließenden Mikroskopaufnahmen lassen sich kristalline Bereiche erkennen.
Reaktion von Brom mit Zink bzw. Magnesium

Im Video wird gezeigt wie Brom, gelöst in Wasser, mit Zink- bzw. Magnesiumpulver reagiert. Die Reaktionsgemische werden anschließend filtriert und die Leitfähigkeiten der entstandenen Lösungen demonstriert.
Reaktion von Iod mit Magnesium in einer ethanolischen Lösung

Im Video wird Iod in Ethanol gelöst. Die Leitfähigkeit der Lösung wird geprüft, dann wird Magnesiumpulver hinzugegeben, die Lösung filtriert, und die Leitfähigkeit der Lösung wird anschließend erneut geprüft.
Fällung von Silberhalogeniden

Im Video wird die Fällung verschiedener Silberhalogenide vor einem schwarzen Kontrasthintergrund gegenübergestellt. Hierzu wird zu einer Kaliumfluorid-, Kaliumchlorid-, Kaliumbromid- und einer Kaliumiodid-Lösung sowie zu zwei Blindproben mit Leitungs- und VE (Vollentsalztes)-Wasser Silbernitrat-Lösung getropft.
Bleiiodid-Düne
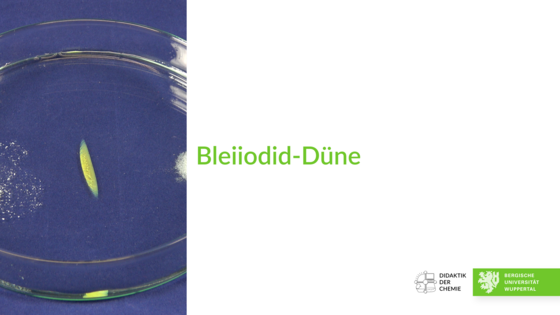
In eine Petrischale, die mit Wasser gefüllt ist, wird auf einer Seite etwas Blei(II)-acetat verteilt, auf der anderen etwas Kaliumiodid.
Die Vorgänge werden über einen längeren Zeitraum beobachtet.
Herstellung von Chlor

Das Video zeigt die Herstellung von Chlorgas durch die Reaktion von konzentrierter Salzsäure und Calciumhypochlorit. Nach einem Überblick über die Versuchsapparatur wird der Versuch gestartet und im Zeitraffer die Beobachtung gezeigt.
Ausschütteln von Bromwasser

Heptan wird vorsichtig mit Bromwasser unterschichtet. Das Reagenzglas wird mit einem Stopfen verschlossen und anschließend kräftig geschüttelt. Ein Vergleich vorher-nachher ist im Video zu sehen.
Ablenkung eines Flüssigkeitsstrahls

Ein Hartgummistab wird mit einem Katzenfell gerieben. Dieser Hartgummistab wird einmal an einen Wasserstrahl und einmal an einen Heptanstrahl gehalten.
Lösen von verschiedenen Salzen in Wasser

Im Video wird gezeigt, wie sich das Lösen verschiedener Salze auf die Temperatur des Lösemittels Wasser auswirken kann.
Wasserberg

Die Oberflächenspannung von Wasser wird demonstriert.
Schwimmende und sinkende Büroklammer

Die Oberflächenspannung von Wasser wird demonstriert und was passiert, wenn diese herabgesetzt wird.
Vergleich von Wasser und Wachs

Das unterschiedliche Verhalten von festem in flüssigem Wasser zu festen in flüssigem Wachs wird demonstriert.
Reaktionsgeschwindigkeit der Reaktion zwischen Ameisensäure und Magnesium

Im Video wird gezeigt, wie mit einer einfachen Versuchsapparatur die Reaktionsgeschwindigkeit der Reaktion zwischen Ameisensäure und Magnesium ermittelt werden kann. Hierzu wird in 10-Sekunden-Abständen das Volumen des entstandenen Gases ermittelt und in einer Tabelle aufgetragen.
Ermittlung der Reaktionsgeschwindigkeit mit Hilfe einer Waage

Auf einer Waage werden 8 g Calciumcarbonat in einem Erlemeyerkolben und 50 mL Ameisensäure, c = 1 mol/L in einem Messzylinder vorgelegt. Die Waage wird auf 0 tariert, dann wird die Ameisensäure zum Calciumcarbonat gegeben und der Erlenmeyerkolben wird auf die Waage gestellt. Ein Teil des Videos wird im Zeitraffer gezeigt, die abgelaufene Reaktionszeit ist stets mit eingeblendet. Zusätzlich werden die Messwerte alle 30 Sekunden auf einem Graphen dargestellt.
Synthese und Analyse von Zinkbromid

In diesem Video wird die Synthese von Zinkbromid und die anschließende Analyse der Substanz gezeigt. Dafür wird Zink-Pulver zu Bromwasser gegeben und anschließend das Gemisch filtriert. Für eine Analyse des Filtrats wird im ersten Schritt Silbernitrat-Lösung hinzugetropft. Im zweiten Schritt wird das Filtrat in ein U-Rohr gefüllt und über zwei Graphitelektroden eine Spannung angelegt. Das Video zeigt im Zeitraffer die Beobachtungen, die sich im U-Rohr und an den Elektroden ergeben.
Das chemische Gleichgewicht am Beispiel von Eisen(III)-thiocyanat
Zunächst werden die verwendeten Gerätschaften und Chemikalien in Wort, Bild und ggf. chemischer Formel vorgestellt. Die Stoffportionen der beiden Chemikalien Kaliumthiocyanat (s) und Eisen(III)-chlorid Hexahydrat (s) sind in jeweils einem Messkolben vorgelegt worden. Fachmännisch werden wässrige Lösungen bereitet. Nach diesem Videoabschnitt, der sich eher mit der Versuchsvorbereitung befasst, folgt der Hauptteil der Versuchsdurchführung: Im ersten Schritt werden die Lösungen vereinigt und das Resultat in Augenschein genommen. Der zweite Schritt gliedert sich in zwei Unterteile. 1. Teil: Die Lösung wird auf drei Reagenzgläser verteilt und Stoffportionen von Kaliumthiocyanat (s) bzw. Eisen(III)-chlorid Hexahydrat (s) hinzugegeben und anschließen im Vergleich mit der Blindprobe in Augenschein genommen. 2. Teil: Es erfolgt die Zugabe von Silbernitratlösung bzw. Natronlauge. Das Resultat wird im Vergleich mit der Blindprobe in Augenschein genommen. Der weiße Kontrasthintergrund ermöglicht ein genaues Beobachten.
Der Stechheberversuch
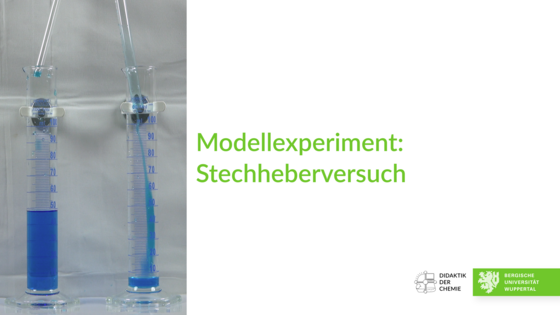
In diesem Video werden zunächst das Laborequipment und die Durchmesser der verwendeten Glasrohre gezeigt. Mithilfe der Glasrohre wird nun der Versuch durchgeführt (kreuzweises Überführen von Flüssigkeitsportionen von einem Messzylinder in den anderen; dies wird als Hub bezeichnet). Die Anzahl der Hübe und das jeweilige Flüssigkeitsvolumen in den beiden Messzylindern wird in einer Tabelle während des laufenden Versuchs eingeblendet. Der Beobachter kann die Volumenveränderungen und die jeweiligen Befüllungen der Glasrohre sehr gut nachvollziehen, da die Flüssigkeit eingefärbt ist und ein weißer Kontrasthintergrund verwendet wird. Nach 22 Hüben über Kreuz wird der Versuch beendet. Es wird mit Zeitraffung gearbeitet, deren Rate eingeblendet wird.
Thermochromie einer Iod-Stärke-Lösung

Im ersten Teil dieses Videos wird zunächst die Zubereitung einer verdünnten Stärkelösung gezeigt. Der schwarze Kontrasthintergrund lässt das Entstehen einer Stärke-Lösung aus einer Stärke-Wasser-Suspension nachvollziehen. Im zweiten Teil des Videos wird die abgekühlte Lösung in ein Reagenzglas überführt und portionsweise unter Rühren mit Lugolscher Lösung versetzt. Dabei wird die ästhetische Wirkung der Lösungsverfärbung in didaktischer Weise genutzt. Das Reagenzglas mit der nun blauen Lösung wird in einen Standzylinder mit heißem bzw. eiskaltem Wasser gehalten und anschließend jeweils in Augenschein genommen. Der weiße Kontrasthintergrund macht ein genaues Beobachten möglich. Das Verwenden von Temperaturfühlern und -anzeigen lässt die jeweils vorliegenden Versuchsbedingungen visuell nachvollziehen. Einige Prozesse werden mithilfe der Zeitraffung dargestellt und die Zeitraffungsrate eingeblendet.
Temperatureinfluss auf das Stickstoffdioxid –Distickstofftetraoxid-Gleichgewicht

In diesem Video werden zunächst die Chemikalien und Materialien mit Abbildung und Name vorgestellt. Dann wird eine mit Stickstoffdioxid gefüllte Glasampulle in heißes Wasser getaucht und anschließend in Augenschein genommen. Dann wird die Ampulle in Eiswasser getaucht und ebenfalls in Augenschein genommen. Dieses Vorgehen wird einige Male wiederholt. Abschließend gibt es drei Bilder der Ampulle bei verschiedenen Temperaturen, die eine abschließende kontrastive Betrachtung ermöglicht. Der verwendete weiße Kontrasthintergrund macht ein genaues Beobachten möglich.
Elektrische Leitfähigkeit verschiedener Säuren

Die elektrischen Leitfähigkeiten von VE Wasser, Citronensäure-Lösung (w = 10%), Essigsäure-Lösung (Essigessenz, w = 25%) und Salzsäure (c = 0,1 mol/L) werden miteinander verglichen, indem die Leuchtstärke einer LED, die in einen entsprechenden Stomkreis eingebaut wurde, beobachtet wird.
Reaktion von Schwefeldioxid mit Wasser

Schwefel wird in einem Verbrennungslöffel entzündet. Der Löffel wird in ein geschlossenes Gefäß gehängt, das unten etwas mit Bromthymolblau angefärbtes und mit einigen Tropfen Natronlauge alkalisch gestelltes Wasser enthält. Die Entstehung der Verbrennungsgase wird beobachtet und eine Farbänderung in der wässrigen Lösung.
Einfluss der Säurestärke auf den pH-Wert

Der pH-Wert von Salzsäure, c = 2 mol/L, und der von Essigsäure, c = 2 mol/L, wird einmal mithilfe eines Indikatorpapiers bestimmt und einmal mithilfe eines pH-Meters.
pH-Werte von wässrigen Lösungen verschiedener Salze

Lösungen von Natriumacetat, Natriumchlorid und Natriumhydrogencarbonat werden mit Bromthymolblau versetzt.
Reaktion von Magnesium mit verschiedenen Säuren

Im Video wird je eine Spatelspitze zu einer Citronensäure-Lösung, einer Essigsäure-Lösung und einer Salzsäure-Lösung gegeben.
Reaktion von Säure mit Marmor

Im Video wird Säure auf Marmor gegeben. Das entstehende Gas wird durch Kalkwasser geleitet.
Säureeinwirkung auf eine Muschel

Auf eine Muschel werden einige Tropfen Salzsäure gegeben.
Erzeugung von Sauerstoff bei der Photosynthese

Eine Wasserpest-Pflanze wird längere Zeit mit einer Pflanzenlampe bestrahlt und das von der Pflanze aufsteigende Gas wird aufgefangen. Mit dem aufgefangenen Gas wird anschließend die Glimmspanprobe durchgeführt.
Sauerstoffnachweis bei der Photosynthese

Wasserpestzweige werden in eine Indigocarmin-Lösung gegeben. Die farblose Lösung wird als Nachweis von Sauerstoff in der Lösung blau.
Verschiedene Indikatoren

Auf einer Tüpfelplatte werden wenige Tropfen Universalindikator, Bromthymolblau, Phenolphthalein und Rotkohlsaft zu einer sauren, einer eher neutralen und zu einer alkalischen Lösung gegeben.
Titration einer starken Säure mit einer starken Base

Salzsäure unbekannter Konzentration wird mit Natronlauge, c = 0,1 mol/L titriert. Die Salzsäure-Lösung wurde mit etwas Bromthymolblau versetzt. Während der Titration wird der pH-Wert mithilfe eines pH-Meters bestimmt. Die bestimmten pH-Werte, die Indikatorfarbe und die zugegebene Menge an Natronlauge werden in einer Tabelle festgehalten.
Reaktionen zwischen Metallen und Metallsalzlösungen

Ein Kupferblech wird in eine Eisen(II)-sulfat-Lösung, ein Eisenblech in einer Kupfer(II)-sulfat-Lösung und ein Kupferblech in eine Silber(I)-nitrat-Lösung gestellt. Die Oberflächen der Bleche werden nach kurzer Zeit näher betrachtet.
Das Daniell-Element

Drei verschiedene Aufbauten des Daniell-Elements mit jeweils gleich konzentrierten Lösungen werden hinsichtlich ihrer Leistungsfähigkeit verglichen: Es wird jeweils die gelieferte Spannung und die Stromstärke verglichen, sowie ob die Zelle dazu in der Lage ist, einen Motor anzutreiben.
Der Zink-Iod-Akku

Eine frische Zinkiodid-Lösung wird mit Strom aus einer Batterie einige Zeit lang elektrolysiert. Das dabei entstehende Iod und Zink wird gezeigt. Anschließend wird die Umkehrung der Reaktion bei Betrieb eines Motors gezeigt.
