Versuche zum Schulorientierten Experimentieren I (SOE1)
Temporäre Wasserhärte

Im Video wird die Temporäre Wasserhärte demonstriert: Es wird Kohlenstoffdioxid in Kalkwasser eingeleitet, bis dieses wieder aufklart. Die klare Lösung wird anschließend mithilfe eines Gasbrenners erhitzt.
Temporäre Wasserhärte - Leitfähigkeit

Die Leitfähigkeit von Kalkwasser wird indirekt bestimmt. Während der Bestimmung wird Kohlenstoffdioxid in das Kalkwasser eingeleitet, bis es aufklart und die gemessene Stromstärke relativ konstant bleibt.
Abgestufte Reaktivität der Halogene

Lösungen von Kaliumchlorid, Kaliumbromid und Kaliumiodid werden vorgelegt. Zu den Lösungen werden einige Milliliter Bromwasser bzw. Chlorwasser gegeben.
Testen des Gasraums einer Salzsäureflasche

Ein angefeuchtetes Stück Indikatorpapier wird über die Öffnung einer Salzsäureflasche (konz.) gehalten.
Entwicklung und Nachweis von Chlorwasserstoffgas

In einer Gasentwicklungsapparatur wird konz. Schwefelsäure auf Natriumchlorid getropft. Das entstehende Gas wird auf die Oberfläche von Wasser geleitet, das mit Indikatorlösung angefärbt wurde.
Der Chlorwasserstoffspringbrunnen

Mithilfe von konz. Schwefelsäure und Natriumchlorid wird ein Kolben mit Chlorwasserstoffgas gefüllt. Der mit einem Glasrohr versehene Kolben wird kopfüber in eine Wanne mit Wasser getaucht, das zuvor mit Bromthymolblau angefärbt wurde. Der Kolben wird einige Zeit mit Eis gekühlt, um den Versuch zu starten.
Der Kerzenversuch mit Wasserstoffgas

Ein Standzylinder wird mit Wasserstoff gefüllt. Anschließend wird von unten eine brennende Kerze mehrmals in diesen eingeführt.
Analyse von Wasser

In einem Rundkolben wird Wasser zum Sieden erhitzt. Der Wasserdampf wird über Magnesiumbandstücke geleitet, die sich in einem Verbrennungsrohr befinden. An der anderen Seite des Verbrennungsrohrs ragt ein gebogenes Glasrohr in eine pneumatische Wanne. Das Magnesiumband wird mit einem Brenner so lange erhitzt, bis es zündet. Das entstehende Gas wird pneumatisch aufgefangen und es wird die Knallgasprobe durchgeführt.
Analyse von Wasser - Reagenzglasvariante

Ein Reagenzglas wird waagerecht eingespannt. Am Boden des Reagenzglases befindet sich Sand, der mit Wasser angefeuchtet wurde, dieser wird mit etwas Glaswolle in Position gehalten. In der Mitte des Reagenzglases werden Magnesiumspäne platziert.
An der Reagenzglasöffnung wird mit Hilfe eines Stopfens ein gebogenes Glasrohr mit Rückshclagsicherung befestigt.
Das Mangesium wird stark erhitzt, danach wird das Wasser erhitzt, damit Wasserdampf über das heiße Magnesium streift. Das austretende Gas wird entzündet.
Bestimmung des Sauerstoffgehalts in der Luft

In einem Verbrennungrohr wird Eisenwolle erhitzt. Das Verbrennungsrohr ist auf beiden Seiten mit je einem Kolbenprober verschlossen. Einer der Kolbenprober enthält 100 mL Luft. Die Luft wird mehrmals über die heiße Eisenwolle streifen gelassen.
Entropie
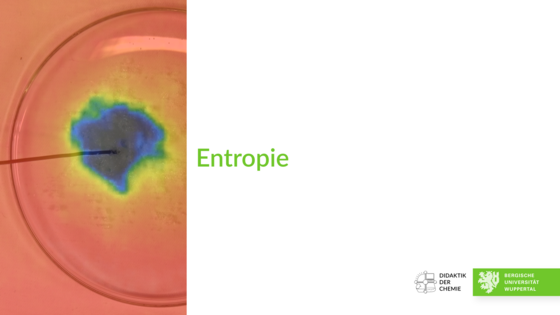
Etwa gleiche Mengen an Natriumcarbonat Decahydrat und Citronensäure werden zusammengegeben und vermischt. Die Temperatur der Mischung wird mit Hilfe eines Temperaturfühlers und mit Hilfe einer Wärmebildkamera verfolgt.
Gravimetrie

Auf einer Waage werden 8 g Calciumcarbonat in einem Erlemeyerkolben und 50 mL Ameisensäure, c = 1 mol/L in einem Erlenmeyerkolben vorgelegt. Die Waage wird auf 0 tariert, dann wird die Ameisensäure zum Calciumcarbonat gegeben und der Erlenmeyerkolben wird auf die Waage gestellt. Ein Teil des Videos wird im Zeitraffer gezeigt, die abgelaufene Reaktionszeit ist stets mit eingeblendet.
pH-Abhängigkeit des Redoxpotenzials

In einem U-Rohr werden die folgenden galvanischen Elemente aufgebaut:
Eine Kupfer-Elektrode in einer Kupfersulfat-Lösung, c = 0,1 mol/L gegen eine Platin-Elektrode in einer Kaliumpermanganat-Lösung, c = 0,1 mol/L, die mit Essigsäure auf pH = 3 eingestellt wurde.
Zum Vergleich wird eine Kupfer-Elektrode in einer Kupfersulfat-Lösung, c = 0,1 mol/L gegen eine Platin-Elektrode in einer Kaliumpermanganat-Lösung, c = 0,1 mol/L, die mit Salzsäure auf pH = 1 eingestellt wurde, geschaltet.
Überspannung sichtbar gemacht

Angelehnt an die Arbeiten von A. Flint et. al. [1] wird in diesem Video die Überspannung bei der Elektrolyse von Wasser an verschiedenen Metallen gezeigt.
In einer Küvette mit Kaliumhydroxid-Lösung, c = 1 mol/L befinden sich Drähte aus Kupfer, Silber, Nickel und Platin. Als Gegenelektrode dient eine Graphitfolie (Wärmeleitfolie). Eine regelbare Spannungsquelle wird über einen Widerstand von 400 Ω mit der Elektrolysezelle verbunden, um die Spannung genauer einstellen zu können. Die Spannung und die Stromstärke, die durch die Zelle fließt werden gleichzeitig gemessen und in einem Stromstärke-Spannungs-Diagramm aufgetragen. Nach Zusammenbau der Zelle wird zögig eine Spannung angelegt und allmählich erhöht, dabei werden die Drähte möglichst genau beobachtet.
Quellen:
[1] L. Wille, A. Witt und A. Flint: Überspannung „sichtbar“ gemacht, CHEMKON 18 (1), 2011; DOI: 10.1002/ckon.201010130
Der Bleiakkumulator

Zwei Bleibleche werden in Schwefelsäure-Lösung, w = 25%, getaucht und es wird eine Weile bei 3 V elektrolysiert. Die Blasenbildung während der Elektrolyse, sowie farbliche Veränderungen nach dem Vorgang werden gezeigt.
Anschließend werden Spannung und Stromstärke der Zelle Qualitativ bestimmt und ein kleiner Elektromotor mt Hilfe des Bleiakkus betrieben.
Der Boyle-Versuch

In einen 1-L-Rundkolben werden 200 mg Aktivkohle gegeben. Anschließend wird er Kolben mit reinem Sauerstoff gefüllt und mit einem Luftballon verschlossen. Der Kolben wird gewogen, bevor die Aktivkohle im Kolben über einem Gasbrenner erhitzt wird. Nach vollständigem Verglühen der Aktivkohle in der Sauerstoffatmosphäre wird der Kolben erneut gewogen.
Balkenwaagenversuch

An einer Balkenwaage werden auf beiden Seiten gleiche Massen an Eisenwolle befestigt, so dass diese im Gleichgewicht ist. Die Eisenwolle auf einer Seite wird angezündet.
Verbrennung in O2 und in CO2 (hintereinander)

Im Video wird gezeigt, was geschieht, wenn brennende Eisenwolle, ein glühendes Stück Holzkohle und ein brennendes Magnesiumband in eine Atmosphäre aus Kohlenstoffdioxid gehalten werden, bzw. wenn sie in eine Atmosphäre aus reinem Sauerstoff gehalten werden.
In diesem Video werden diese Versuche hintereinander gezeigt.
Verbrennung in O2 und in CO2 (Vergleich)

Im Video wird gezeigt, was geschieht, wenn brennende Eisenwolle, ein glühendes Stück Holzkohle und ein brennendes Magnesiumband in eine Atmosphäre aus Kohlenstoffdioxid gehalten werden, bzw. wenn sie in eine Atmosphäre aus reinem Sauerstoff gehalten werden.
In diesem Video werden diese Versuche vergleichend nebeneinander gezeigt.
