| Die Molekülform der Cyclodextrine kann grob als hohler Kegelstumpf ohne Deckel und Boden beschrieben werden. Damit verbunden ist die Fähigkeit der Cyclodextrine, so genannte Wirt-Gast-Komplexe mit verschiedenen Verbindungen zu bilden. Die Cyclodextrin-Moleküle fungieren als Wirt für verschiedenste Gast-Komponenten, die auf der Basis von zwischenmolekularen Wechselwirkungen in dem Hohlraum der Cyclodextrine stabilisiert werden. | ||||||||||||
 |
||||||||||||
| Abb. 1.21: Schematische Darstellung eines Cyclodextrin-Moleküls als hohler Kegelstumpf | ||||||||||||
 |
||||||||||||
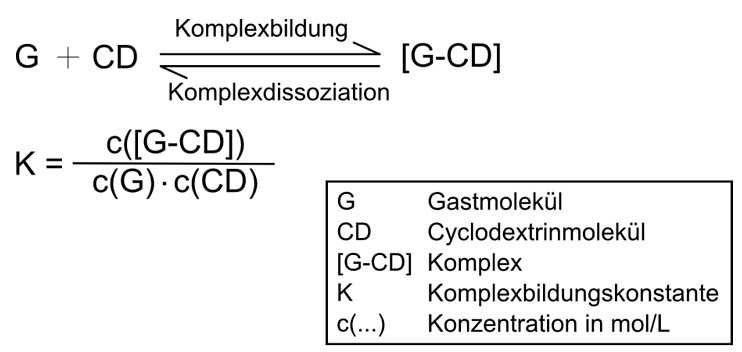
| Abb. 1.22: Die Komplexbildungskonstante gibt die Stabilität eines Wirt-Gast-Komplexes an | ||||||||||||
| Die Strukturen der Gast-Komponenten, die mit Cyclodextrinen Wirt-Gast-Komplexe eingehen können, sind sehr vielfältig. Das Spektrum der Gast-Komponenten reicht von hydrophoben Stoffen wie Alkanen oder aromatischen Kohlenwasserstoffen über polare, organische Stoffe bis hin zu einfachen Anionen. Es stellt sich also die Frage, welche Voraussetzungen vorliegen müssen, damit ein Cyclodextrin-Komplex gebildet wird. | ||||||||||||
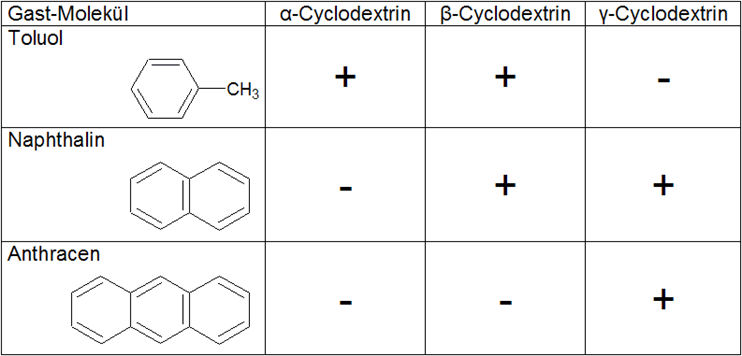
| Der wichtigste Faktor ist die Größe des Gastes. Einerseits darf die Gast-Komponente nicht zu klein sein, da es bei zu großen Abständen zwischen dem Gast und der Innenseite des Cyclodextrin-Moleküls nicht zur Ausbildung zwischenmolekularer Kräfte kommen kann. Ist der Gast hingegen zu groß, so kann es aus sterischen Gründen nicht zur Komplexbildung kommen. Dabei ist zu bedenken, dass auch nur Teile eines Gast-Moleküls in dem Hohlraum komplexiert werden können. Die Größe der Kavität in Bezug auf die Größe des Gastes ist also entscheidend für die Komplexbildung. In der Tabelle ist dargestellt, wie sich die Größe der Gast-Moleküle auf die Komplexbildung am Beispiel aromatischer Kohlenwasserstoffe auswirkt. | ||||||||||||
 |
||||||||||||
| Tab. 1.5: Fähigkeit der Komplexbildung mit aromatischen Kohlenwasserstoffen | ||||||||||||
| Diese Selektivität in der Komplexbildung macht man sich bei der industriellen Produktion zunutze, indem man selektive Fällungsreagenzien für ein Cyclodextrin einsetzt. Einen weiteren Faktor, der Einfluss auf die Komplexbildung hat, stellt die Ladung und Polarität der Gast-Komponente dar. Generell kann man sagen, dass sich sehr gut wasserlösliche, stark hydrophile und deshalb gut hydratisierbare Spezies nicht für die Komplexbildung eignen. Inwiefern die Ladung der Spezies die Komplexbildung begünstigt, ist nicht genau vorhersehbar. Beispielsweise führt bei der Komplexierung von p-Nitrophenolat im Vergleich zu p-Nitrophenol die Ladung zu einem stabileren Komplex. Der Grund ist in diesem Fall in dem größeren Dipolmoment des Anions zu suchen. Der Gast p-Nitrophenolat kann damit im Cyclodextrin-Molekül einen stärkeren Dipol induzieren. Damit sind die Dipol-Dipol-Wechselwirkungen größer, wodurch der Komplex stabilisiert wird. Die Einflüsse auf die Komplexbildung müssen aber für jede Gast-Komponente erneut abgeschätzt und experimentell untersucht werden. |
||||||||||||
| Bisher wurden Faktoren aufgeführt, die erforderlich oder förderlich bei der Komplexbildung sind. Welche treibenden Kräfte bei der Bildung von Wirt-Gast-Komplexen wirksam werden, soll nun im Folgenden betrachtet werden. Nach dem zweiten Hauptsatz der Thermodynamik läuft eine Reaktion selbsttätig ab, wenn für die Gibbssche Energie ΔG < O gilt. Nach der Gleichung ΔG = ΔH – T * ΔS wird die Triebkraft sowohl durch das Streben nach minimaler Enthalpie des Systems als auch durch das Streben nach maximaler Entropie des Systems beeinflusst. Das Zustandekommen zwischenmolekularer Wechselwirkungen zwischen Wirt und Gast führt zwar zur Absenkung der Enthalpie des Systems, jedoch können die relativ schwachen Wechselwirkungen nicht allein die treibende Kraft der Komplexbildung darstellen. Eine entscheidende Rolle scheint das Wasser bei der Komplexbildung einzunehmen. Denn es erfolgt zum Beispiel keine Komplexbildung der Benzoesäure in organischen Lösemitteln wie Benzol oder Chloroform. Benzoesäure lässt sich aber sehr wohl in Cyclodextrin komplexieren, wenn man als Lösemittel Wasser wählt. Die Beteiligung des Wassers hat sowohl einen enthalpischen wie auch einen entropischen Effekt auf die Bildung von Wirt-Gast-Komplexen. Zum einen werden bei der Komplexbildung die sich in der Kavität befindlichen Wassermoleküle gegen eine Gast-Komponente ausgetauscht. In Abhängigkeit von der Größe der Cyclodextrin-Moleküle befindet sich eine gewisse Anzahl an Wassermolekülen in der Kavität (siehe Tab. 1.6). Durch Vertreiben der Wasser-Moleküle durch ein anderes Gast-Molekül nimmt die Entropie des Systems zu, was die Komplexbildung begünstigt. |
||||||||||||
|
||||||||||||
| Tab. 1.6: Anzahl der Wassermoleküle in der Kavität der natürlichen Cyclodextrine | ||||||||||||
| Neben dem Entropieeffekt gibt es auch einen Enthalpiegewinn. Im Inneren der Cyclodextrin-Moleküle befinden sich selbst im kristallinen Zustand Wasser-Moleküle, die aufgrund der Begrenzung durch die unpolare Innenseite des Cyclodextrin-Moleküls und der geringen Anzahl an Wasser-Molekülen in der nächsten Umgebung nicht in vollem Maße ihre Wasserstoffbrückenbindungen ausbilden können. Somit sind die Wasser-Moleküle in der Kavität enthalpiereicher als die Wasser-Moleküle im Lösemittel. Eine Verdrängung dieser Wasser-Moleküle aus der Kavität des Cyclodextrin-Moleküls und die vollständige Ausbildung von Wasserstoffbrückenbindungen führen zur Absenkung der Enthalpie und beeinflussen die Komplexbildung somit positiv. | ||||||||||||
 |
||||||||||||
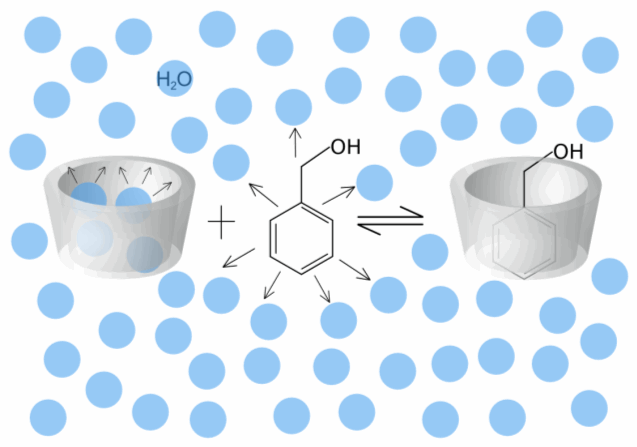
| Abb. 1.23: Schematische Darstellung der Komplexbildung von Benzylalkohol, in der die Pfeile abstoßende Kräfte anzeigen | ||||||||||||
| Bei der Komplexbildung ist ein weiterer Enthalpieeffekt zu berücksichtigen, denn durch Komplexierung kann es zu einem Energiegewinn kommen, der im Abbau der Ringspannung im Cyclodextrin-Molekül begründet ist. Dieser Effekt ist vor allem beim α-Cyclodextrin zu beobachten, da bei der Komplexbildung die Verdrehung einer Glucose-Einheit im α-Cyclodextrin-Molekül aufgehoben wird. Weiterhin üben Solvatationsprozesse Einfluss auf die Komplexbildung aus. Kann das Gast-Molekül in Wasser nicht hydratisiert werden (siehe Abb. 1.23), so führt die Komplexbildung zu einem Energiegewinn, da abstoßende Wechselwirkungen zwischen den Gast-Molekülen und den Wasser-Molekülen aufgehoben werden, wenn das Gast-Molekül im Cyclodextrin komplexiert wird. Zusammenfassend lässt sich sagen, dass mehrere Faktoren die Bildung eines Wirt-Gast-Komplexes beeinflussen. Da die Effekte sich auch untereinander beeinflussen, lässt sich keine Hierarchie der Einflussfaktoren festlegen, zumal die Effekte bei jedem Gast-Molekül unterschiedlich geartet sind. |
||||||||||||
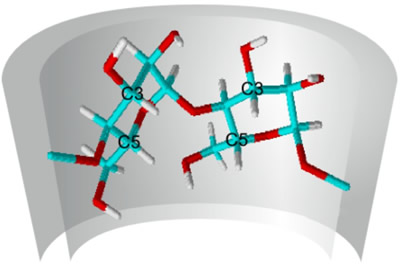
| Die Komplexierung eines Gast-Moleküls in Cyclodextrinen kann durch verschiedene Methoden untersucht werden. Einen direkten Nachweis für die Komplexbildung können 1H-NMR-Spektren liefern, in denen die Wasserstoff-Atome an den Kohlenstoffatomen 3 und 5 jeder Glucose-Einheit im Cyclodextrin-Molekül im Vergleich zu den Spektren der reinen Cyclodextrine verschoben sind. | ||||||||||||
 |
||||||||||||
| Abb. 1.24: Durch die zwischenmolekularen Wechselwirkungen im Wirt-Gast-Komplex werden die Signale der nach innen gerichteten Wasserstoff-Atome des Cyclodextrin-Moleküls verschoben | ||||||||||||
| Eine weitere Methode zur Untersuchung von Wirt-Gast-Komplexen mit Cyclodextrinen ist die UV-VIS-Spektroskopie, die zur Anwendung kommen kann, wenn sich das Absorptionsspektrum des Gast-Moleküls durch die Komplexbildung ändert. Da durch die Bildung eines Wirt-Gast-Komplexes das Gast-Molekül vor Reaktionspartnern abgeschirmt ist, kann sich die Komplexbildung auch durch eine veränderte Reaktivität der Gast-Komponente nachweisen lassen. Über analytische Methoden ist es außerdem möglich, die Stöchiometrie des Wirt-Gast-Komplexes zu bestimmen. Bisher wurde nicht in Betracht gezogen, dass ein Gast-Molekül von mehreren Cyclodextrin-Molekülen komplexiert werden kann. Allerdings findet man zum Beispiel für den Komplex des Retinols ein Verhältnis von Cyclodextrin zu Retinol von 2 : 1 (siehe Abb. 1.25). |
||||||||||||
|
||||||||||||
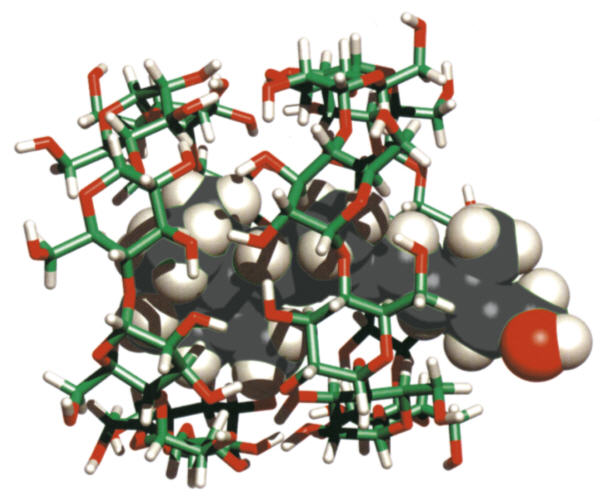
| Abb. 1.25: Zwei Cyclodextrin-Moleküle (dargestellt im Stäbchen-Modell) komplexieren ein Retinol-Molekül (als Kalottenmodell) | ||||||||||||
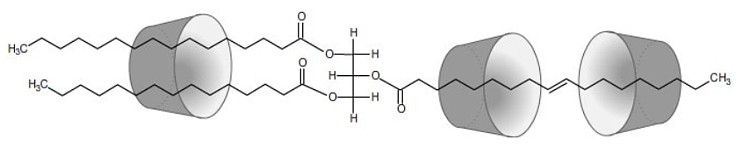
| Die Komplexierung von Gast-Molekülen ist relativ gut erforscht, da die Einsatzmöglichkeiten für Anwendungen sehr vielseitig sind. Durch die Bildung der Cyclodextrin-Komplexe können die Gast-Moleküle in ihren physikalischen und chemischen Eigenschaften verändert werden. So können leicht flüchtige Stoffe wie Aromastoffe durch Komplexierung in Cyclodextrinen am schnellen Verflüchtigen gehindert werden, da die leicht flüchtigen Gast-Moleküle aufgrund der ausgebildeten zwischenmolekularen Wechselwirkungen einen wesentlich geringeren Dampfdruck aufweisen. Außerdem können oxidationsempfindliche Gast-Moleküle wie die Omega-3,6-Fettsäuren vor dem Abbau durch den Luftsauerstoff geschützt werden. Wegen der langen Fettsäure-Reste können an der Komplexierung eines Moleküls mehrere Cyclodextrin-Moleküle beteiligt sein (siehe Abb. 1.26). |
||||||||||||
 |
||||||||||||
| Abb. 1.26: Die langen Alkylketten können von mehreren Cyclodextrin-Molekülen komplexiert werden | ||||||||||||
| Auch die Zerstörung der Gast-Moleküle durch photooxidative Abbaureaktionen wird deutlich verzögert, so dass die Gast-Moleküle vor Licht geschützt sind. Den Einzug in die pharmazeutische Forschung fanden die Cyclodextrine vor allem deshalb, weil über die Komplexierung von Wirkstoffen in Cyclodextrinen die Wasserlöslichkeit und damit auch die Bioverfügbarkeit von Arzneistoffen erhöht werden kann. | ||||||||||||
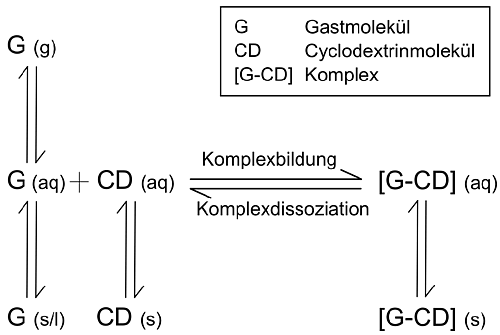
| Zur Herstellung der Wirt-Gast-Komplexe können unterschiedliche Methoden angewandt werden, bei denen die in der Abb. 1.27 dargestellten Gleichgewichte berücksichtigt werden müssen. | ||||||||||||
 |
||||||||||||
| Abb. 1.27: Gleichgewichte, die bei der Komplexbildung eine Rolle spielen | ||||||||||||
| Bei der Komplexbildung aus einer Lösung wird die Gast-Komponente in einem äquimolaren Verhältnis zu einer nahezu gesättigten Lösung hinzugegeben. Mit eher hydrophoben Gast-Komponenten bildet sich der Komplex als Niederschlag während des Rührens. Der Feststoff wird abfiltriert, gewaschen und unter Vakuum getrocknet. Handelt es sich bei dem Gast um eine leicht flüchtige Verbindungen sollte nicht unter Vakuum getrocknet werden, da dann das Gleichgewicht durch Entfernen des Gastes mit einer ständigen Komplexdissoziation reagiert. Ist der Komplex wasserlöslich, kann die Ausfällung des Komplexes durch Zugabe eines unpolaren Lösemittels ermöglicht werden. Vor allem bei dem schlecht wasserlöslichen β-Cyclodextrin bietet sich das Verfahren der Komplexbildung aus einer Suspension an. Auch hier gibt man die Gast-Komponente in einem äquimolaren Verhältnis hinzu und rührt 12 bis 24 Stunden. Die Aufarbeitung kann dann wie oben beschrieben erfolgen. |
||||||||||||
Literatur:
|
||||||||||||
| | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |