1. Experiment ist im WACKER-Schulversuchskoffer enthalten |
nein |
2. Versuchsvorschrift wurde modifiziert |
nein |
3. Video-Clip verfügbar |
nein |
4. Flash-Animation verfügbar |
nein |
|
 |
6. Komplexierung von Salicylsäure |
 |
  1
Materialien, Chemikalien, Zeitbedarf 1
Materialien, Chemikalien, Zeitbedarf |
 |
- Bechergläser (50 mL, 25 mL)
- Messzylinder (25 mL)
- Waage
- Spatel
- Magnetrührer mit Heizplatte
- Rührstäbchen
- Filter
- Filterpapier
- Trockenschrank
- Thermometer
- Ölbad
- Reagenzgläser
- Reagenzglasständer
- Pipette
- β-Cyclodextrin
- destilliertes Wasser
- Ethanol F, Xn
- Salicylsäure Xn
- Eisen(III)-chlorid Xn
Im Unterricht kann dieser Versuch nicht an einem Tag durchgeführt werden, da der entstandene Komplex zunächst getrocknet werden muss. Für die Herstellung des Komplexes benötigt man ca. 20 Minuten. Wenn der Feststoff dann trocken ist und das Ölbad auf die benötigte Temperatur vorgeheizt wurde, können die Untersuchungen des Komplexes in der folgenden Unterrichtsstunde innerhalb weniger Minuten durchgeführt werden. |
 |
  2
Versuchsdurchführung und -beobachtung 2
Versuchsdurchführung und -beobachtung |
 |
Es wird 1 g β-Cyclodextrin in 20 mL eines Wasser-Ethanol-Gemischs w(Ethanol) = 30% gelöst. Die Lösung wird unter Rühren auf ca. 55° C erhitzt. Dann gibt man tropfenweise eine Lösung aus 0,1 g Salicylsäure in 2-3 mL Ethanol hinzu und rührt für weitere zehn Minuten. Nachdem sich die Lösung langsam auf Raumtemperatur abgekühlt hat, wird der Niederschlag abfiltriert und mit Ethanol gewaschen. Von dem Filtrat werden für die Untersuchungen einige Milliliter zurückgehalten. Der Filterrückstand wird im Trockenschrank bei 30° C getrocknet. Der entstandene Feststoff wird dann folgenden Untersuchungen unterzogen. Man gibt 0,5 g des Feststoffes in ein Reagenzglas und gibt das Reagenzglas in ein Ölbad, das auf 110° C aufgeheizt wurde. Es sollte nur der untere Teil des Reagenzglases in das heiße Öl eintauchen. Zum Vergleich gibt man ein Reagenzglas mit 0,5 g Salicylsäure in das Ölbad. Nach einigen Minuten beobachtet man die Veränderungen in den Reagenzgläsern. Für eine weitere Untersuchung gibt man jeweils eine Spatelspitze
- Salicylsäure,
- β-Cyclodextrin,
- Salicylsäure und β-Cyclodextrin,
- des getrockneten Produktes in ein Reagenzglas.
- In ein weiteres Reagenzglas werden einige Millliliter des Filtrats gegeben.
Als Reagenzlösung verwendet man eine verdünnte, schwach gelbe Eisen(III)-chlorid-Lösung, von der man jeweils einige Milliliter in die Reagenzgläser tropft. Man beobachtet die Verfärbung. Um Unterschiede in den Färbungen zu erkennen, kann es nötig sein, die Lösungen mit destilliertem Wasser zu verdünnen. Beim Abkühlen der wässrigen Lösung auf Raumtemperatur ist die Bildung eines farblosen Niederschlages zu beobachten, der nach dem Trocknen pulverförmig ist. Während Salicylsäure bei 110° C sehr gut sublimiert und lange feine Nadeln bildet, ist bei dem Komplex keine Sublimation zu erkennen. |
 |
| Abb. 2.27: Salicylsäure sublimiert sehr gut, der Komplex von Salicylsäure mit β-Cyclodextrin zeigt keine Sublimation mehr |
 |
| Bei den Untersuchungen mit Eisen(III)-chlorid zeigt sich bei β-Cyclodextrin keine Verfärbung. In den anderen Reagenzgläsern ist eine Violettfärbung zu beobachten, die aber unterschiedlich stark ausfällt. Während mit Salicylsäure, dem Gemisch aus Salicylsäure und β-Cyclodextrin und dem Filtrat eine starke Violettfärbung auftritt, führt der Zusatz der Eisen(III)-chlorid-Lösung zu dem Komplex nur zu einer schwachen Verfärbung (siehe Abb. 2.28). |
 |
Salicylsäure |
β-Cyclodextrin |
Salicylsäure und β-Cyclodextrin |
Filtrat |
Salicylsäure- β-Cyclodextrin-Komplex |
|
| Abb. 2.28: Der Nachweis von Salicylsäure erfolgt durch Violettfärbung nach Zugabe einer Eisen(III)-chlorid-Lösung |
 |
|
  3
Versuchsauswertung 3
Versuchsauswertung
|
 |
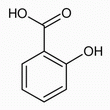
Die schlecht wasserlösliche Salicylsäure wird in Ethanol gelöst und dann zu der Cyclodextrin-Lösung gegeben. Der Komplex bildet sich also in Lösung und fällt beim Abkühlen der Lösung auf Raumtemperatur aus. In der Wirt-Gast-Beziehung bestehen zwischen dem Salicylsäure-Molekül und dem Cyclodextrin-Molekül van-der-Waals-Kräfte und Wasserstoffbrückenbindungen, die den Komplex stabilisieren. |
|
Die Komplexierung der Salicylsäure in dem Cyclodextrin-Hohlraum ist so stabil, dass typische Eigenschaften der Salicylsäure ausbleiben. Zum einen kann man zeigen, dass der Salicylsäure-β-Cyclodextrin-Komplex bei ca. 110° C keine Sublimation zeigt, während die reine Salicylsäure ab 76° C sublimiert und in Form langer, feiner Nadeln im oberen Teil des Reagenzglases resublimiert (siehe Abb. 2.27). |
|
| Abb. 2.29: Salicylsäure |
 |
| Zum anderen lässt sich Salicylsäure mit Eisen(III)-chlorid nachweisen, da Salicylsäure (2-Hydroxybenzoesäure) mit Eisen(III)-chlorid violett gefärbte Salze bildet. In der Probe mit dem Salicylsäure-β-Cyclodextrin-Komplex bleibt die Violettfärbung zwar nicht vollständig aus, sie fällt aber wesentlich schwächer aus als mit freier Salicylsäure. Dafür können zwei Gründe angeführt werden. In dem Feststoff könnten noch geringste Mengen nicht komplexierter Salicylsäure vorliegen. Oder es kommt durch Zugabe der wässrigen Eisen(III)-chlorid-Lösung zur Dissoziation des Komplexes, so dass die Nachweisreaktion dann positiv ausfällt. Für den Nachweis, dass tatsächlich ein Salicylsäure-β-Cyclodextrin-Komplexes gebildet wurde, sind beide Untersuchungen notwendig. Denn das Ausbleiben der Sublimation könnte auch bedeuten, dass in dem Feststoff keine Salicylsäure vorhanden ist. Doch die Reaktion mit Eisen(III)-chlorid ist ein eindeutiger Nachweis für Salicylsäure, denn mit β-Cyclodextrin ist keine Violettfärbung durch Zusatz von Eisen(III)-chlorid-Lösung zu beobachten. Die Reaktion mit Eisen(III)-chlorid alleine würde auch nicht ausreichen, da die Salicylsäure auch frei im Gemisch mit β-Cyclodextrin vorliegen könnte. |
 |
  4
Tipps und Anmerkungen 4
Tipps und Anmerkungen
|
 |
| Statt mit einer einfachen Filtration kann der Feststoff auch schneller mit einem Glasfiltertiegel und einer Wasserstrahlpumpe abgesaugt werden. Dann ist der Komplex auch schon wesentlich trockener. |
 |
  5 Ergänzende Sachinformationen 5 Ergänzende Sachinformationen |
 |
Die Untersuchungen müssen mit dem getrockneten Komplex durchgeführt werden, da bei Anwesenheit von Wasser immer ein Gleichgewicht zwischen dem Komplex und den dissoziierten Molekülen vorliegt und die Bildung eines Komplexes somit nicht nachgewiesen werden kann. |
 |
  6 Literatur 6 Literatur |
 |
- Woyke, A.; „Cyclodextrine“ – Molekulare Zuckertüten. Ein Chemie-Praktikum für die 13.Klasse (www.science-forum.de/download/Cyclo-praktikum.pdf)
- Römpp Online Chemielexikon Version 2.13; Stichwort „Salicylsäure“
- Becker, H.G.O.; Organikum; Wiley-VCH Weinheim, 2001, S. 548
|
 |
  | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |
|


