 |
||||||||||||||||||||
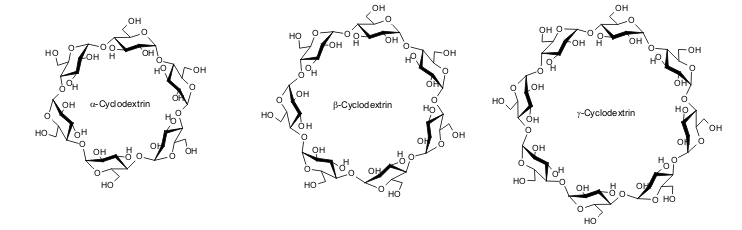
| Abb. 1.15: Molekülstruktur der drei natürlichen Cyclodextrine | ||||||||||||||||||||
| Die Molekülstruktur der Cyclodextrine weist eine interessante Architektur auf, die auch der Grund für das große Interesse an den cyclischen Oligosacchariden ist. Die dreidimensionale Form kann mathematisch als offener Kegelstumpf bezeichnet werden. Die Umschreibung als „molekulare Zuckertüte“ bezieht sich auf die Zusammensetzung eines Cyclodextrin-Moleküls aus mehreren Glucose-Einheiten, während das Bild des „kleinsten Kosmetikkoffers der Welt“ schon auf die Verwendung der Cyclodextrine in der Kosmetik hinweist. | ||||||||||||||||||||
|
||||||||||||||||||||
| Tab. 1.2: Ausmaße der Kavitäten bei Cyclodextrin-Molekülen | ||||||||||||||||||||
| |
||||||||||||||||||||
 |
||||||||||||||||||||
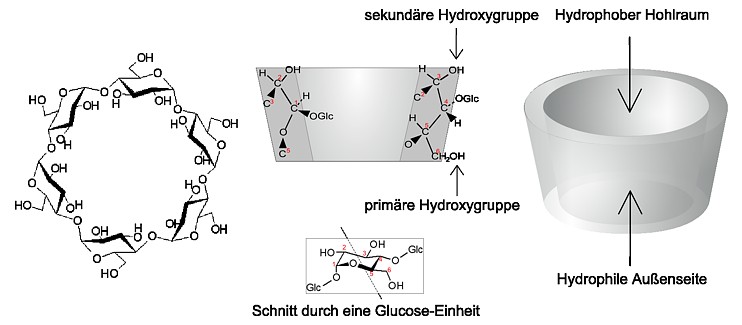
| Abb. 1.16: Molekülstruktur von β-Cyclodextrin, Querschnitt durch ein Cyclodextrin-Molekül mit der Anordnung einer Glucose-Einheit und Darstellung als Konus mit hydrophiler Außenseite und hydrophobem Hohlraum | ||||||||||||||||||||
Die beschriebene Struktur der Cyclodextrine lässt sich wesentlich besser erschließen, wenn man die räumliche Struktur an einem dreidimensionalen und bewegten Molekülmodell betrachtet (Flash-Animation). In der Abb. 1.16 kann man erkennen, dass sich die Hydroxygruppen am oberen und unteren Rand des Cyclodextrin-Moleküls befinden. Nach innen ragen nur die Wasserstoff-Atome an den Kohlenstoff-Atomen 3 und 5 (siehe Abb. 1.16) und die Sauerstoffatome der glykosidischen Bindung zwischen zwei Glucose-Einheiten (siehe Abb. 1.17). Da es an der Innenseite des Cyclodextrin-Moleküls keine protischen Wasserstoff-Atome gibt, ist die Innenseite im Vergleich zur Außenseite mit den sekundären und primären Hydroxygruppen hydrophob. Durch die nach innen ragenden Sauerstoff-Atome ist die Elektronendichte im Inneren relativ hoch, so dass der Hohlraum eine weiche Lewis-Base darstellt. |
||||||||||||||||||||
 |
||||||||||||||||||||
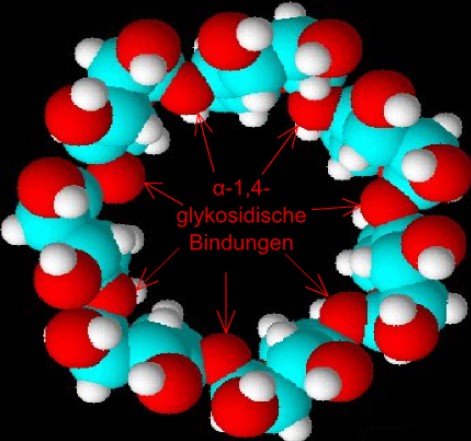
| Abb. 1.17: Blick von oben in ein β-Cyclodextrin-Molekül; am oberen Rand befinden sich die sekundären Hydroxygruppen | ||||||||||||||||||||
|
||||||||||||||||||||
| Tab. 1.3: Löslichkeiten von α-Cyclodextrin, β-Cyclodextrin und γ-Cyclodextrin | ||||||||||||||||||||
|
||||||||||||||||||||
| Tab. 1.4: Löslichkeiten von Glucose, Fructose, Saccharose und Stärke | ||||||||||||||||||||
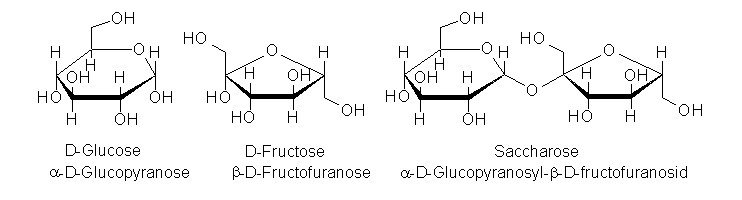
| Vergleicht man die Löslichkeiten von α-Cyclodextrin, β-Cyclodextrin und γ-Cyclodextrin, so erkennt man deutliche Unterschiede in den Löslichkeiten, die aber nicht mit der Ringgröße korrelieren. Denn während α-Cyclodextrin und γ-Cyclodextrin ähnliche Löslichkeiten aufweisen, zeigt β-Cyclodextrin eine ungefähr zehnfach geringere Löslichkeit. Diese Unterschiede lassen sich mit Hilfe der Molekülstrukturen erläutern. Bei der gut löslichen Glucose sind in jedem Molekül (siehe Abb. 1.18) fünf Hydroxygruppen vorhanden, die mit dem Lösemittel Wasser Wasserstoffbrückenbindungen eingehen können. Auch in dem Saccharose-Molekül (siehe Abb. 1.18) sind trotz einer α-1,4-glykosidischen Bindung noch acht Hydroxygruppen vorhanden, die für die sehr gute Wasserlöslichkeit des Haushaltszuckers verantwortlich sind. Hinzu kommt die deutlich größere Wasserlöslichkeit der Fructose im Vergleich zur Glucose. | ||||||||||||||||||||
 |
||||||||||||||||||||
| Abb. 1.18: Molekülstruktur verschiedener Kohlenhydrate | ||||||||||||||||||||
 |
||||||||||||||||||||
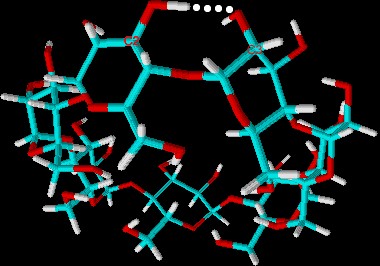
| Abb. 1.19: Intramolekulare Wasserstoffbrückenbindung im β-Cyclodextrin-Molekül | ||||||||||||||||||||
| Da das β-Cyclodextrin-Molekül ein recht starres Molekül ist, sind die intramolekularen Wasserstoffbrückenbindungen im β-Cyclodextrin am stärksten ausgebildet. Dass diese intramolekularen Wechselwirkungen tatsächlich für die geringe Wasserlöslichkeit verantwortlich sind, lässt sich nachweisen, indem man im Cyclodextrin-Molekül einige der Hydroxygruppen derivatisiert. Durch Methylierung erhält man das Cyclodextrin-Derivat Methyl-β-Cyclodextrin (siehe Abb. 1.20), von dem sich bei 25° C 800 g/L in Wasser lösen lassen. Je nach Substitutionsgrad der Hydroxygruppen durch Methoxygruppen verbessert sich die Wasserlöslichkeit, bis sie ab einem gewissen Substitutionsgrad wieder abnimmt, da dann nur noch wenige Hydroxygruppen zur Ausbildung von Wasserstoffbrückenbindungen vorhanden sind. | ||||||||||||||||||||
 |
||||||||||||||||||||
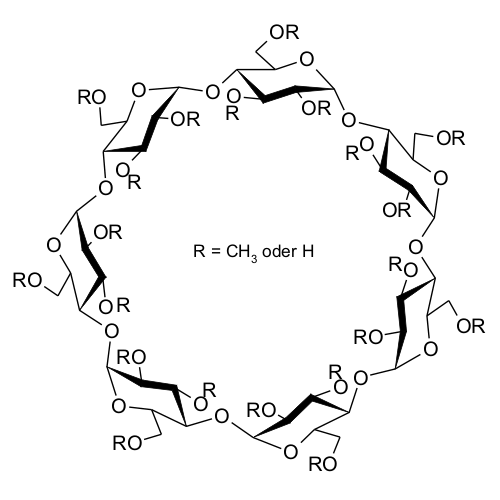
| Abb. 1.20: Molekülstruktur von Methyl-β-Cyclodextrin | ||||||||||||||||||||
Neben der vielfach höheren Löslichkeit in Wasser ergeben sich durch die Methylierung weitere Eigenschaftsänderungen. Während die natürlichen Cyclodextrine aufgrund der polaren Molekül-Außenseite in organischen Lösemitteln schlecht löslich sind, bewirkt die Methylierung der Hydroxygruppen eine gute Löslichkeiten in organischen Lösemitteln. Durch Verdrehung einer Glucose-Einheit im α-Cyclodextrin-Molekül bildet α-Cyclodextrin kein regelmäßiges Sechseck, wodurch die beschriebenen intramolekularen Wasserstoffbrücken nicht vollständig ausgebildet werden können, was zu einer verbesserten Wasserlöslichkeit im Vergleich zu β-Cyclodextrin führt. γ-Cyclodextrin ist wegen der größeren Anzahl der Glucose-Einheiten ein weniger starres Molekül, woraus eine bessere Löslichkeit im Vergleich zu β-Cyclodextrin resultiert. |
||||||||||||||||||||
Literatur:
|
||||||||||||||||||||
| | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |