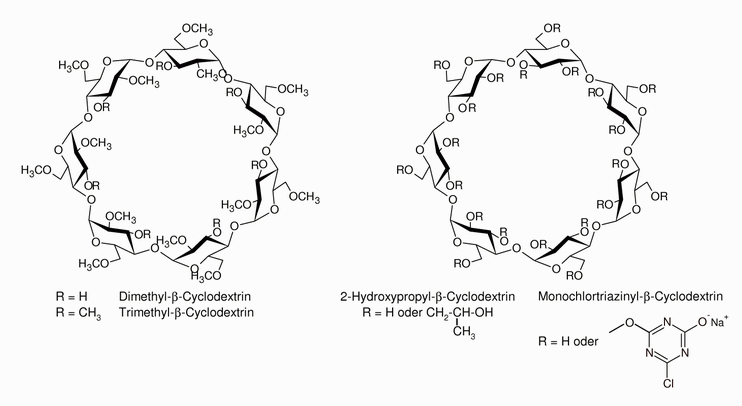
| Aufgrund der großen Anzahl an Hydroxygruppen in einem Cyclodextrin-Molekül (18, 21 bzw. 24 Hydroxygruppen in α-Cyclodextrin, β-Cyclodextrin bzw. γ-Cyclodextrin) ist die Anzahl an möglichen Derivaten der natürlichen Cyclodextrine sehr groß. Die Hydroxygruppen lassen sich auf vielfältige Weise in andere funktionelle Gruppen überführen. Deshalb überrascht es nicht allzu sehr, dass im Jahr 2003 schon 1500 Derivate aus Veröffentlichungen bekannt sind. Ein sehr großer Anteil der bekannten Derivate wird allerdings für immer den Status eines Forschungsobjektes behalten, da die Synthesen für die industrielle Produktion zu kompliziert und arbeitsaufwändig sind. Allerdings werden ca. 100 Derivate industriell hergestellt und als Spezialchemikalien vertrieben. In größerem Maßstab wird neben methylierten und hydroxypropylierten Cyclodextrinen vor allem das reaktive Monochlortriazinyl-Cyclodextrin hergestellt, dass zur Ausrüstung von Textilien eingesetzt wird. In der Abb. 1.28 sind die Molekülstrukturen der Cyclodextrin-Derivate aufgeführt, die von der Wacker Chemie AG produziert werden. |
||||||||
 |
||||||||
| Abb. 1.28: Molekülstrukturen der von WACKER produzierten Cyclodextrin-Derivate | ||||||||
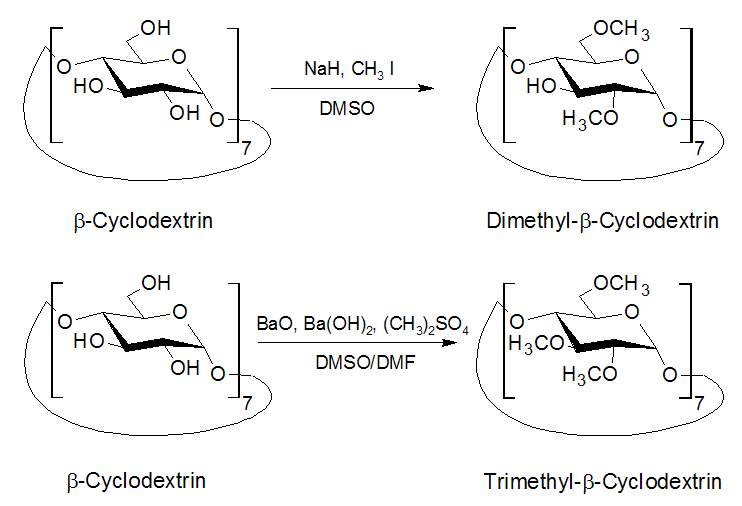
Zur Herstellung dieser Ester-Derivate werden als Alkylierungsreagenzien Iodmethan oder Dimethylsulfat verwendet. Unter alkalischen Bedingungen entstehen die Ether unter folgenden Reaktionsbedingungen: |
||||||||
 |
||||||||
| Abb. 1.29: Verschiedene Reaktionsbedingungen führen zu tri- oder dimethyliertem Cyclodextrin | ||||||||
Die Synthese teilmethylierten Cyclodextrins wird aufgrund der unterschiedlichen Reaktivitäten der Hydroxygruppen an den Kohlenstoff-Atomen 2, 3 und 6 möglich. Die Hydroxygruppe an dem Kohlenstoff-Atom 2 ist am reaktivsten, die am Kohlenstoff-Atom 3 am wenigsten reaktiv. Doch bei extremen Reaktionsbedingungen sind die Unterschiede zu gering, um eine selektive Methylierung zu erreichen. Mit der Derivatisierung ändert sich neben der Höhe und dem Durchmesser der unteren Öffnung des Cyclodextrin-Moleküls vor allem die Löslichkeit in Wasser. Durch Einführung der Methylgruppen steigt die Wasserlöslichkeit an, bis 2/3 der Hydroxygruppen substituiert wurden. Bei weiterer Methylierung wird das Produkt wieder schlechter wasserlöslich. Doch sogar das Trimethyl-β-Cyclodextrin weist noch eine höhere Löslichkeit auf als das natürliche β-Cyclodextrin. |
||||||||
|
||||||||
| Tab. 1.7: Löslichkeit von β-Cyclodextrin, Dimethyl-β-Cyclodextrin und Trimethyl-β-Cyclodextrin in Wasser | ||||||||
 |
||||||||
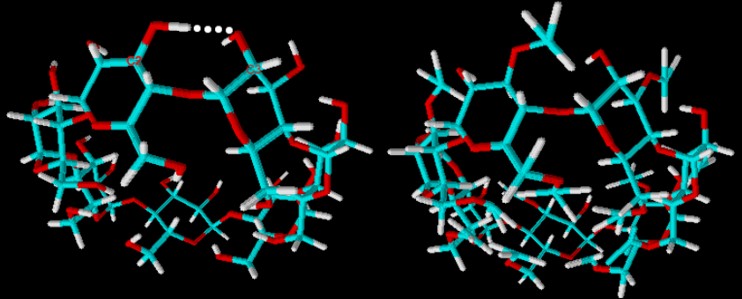
| Abb. 1.30: Vergleich der Molekülstruktur von β-Cyclodextrin und Dimethyl-β-Cyclodextrin | ||||||||
Der Grund für die bessere Wasserlöslichkeit des vollständig methylierten β-Cyclodextrins gegenüber dem natürlichen β-Cyclodextrin lässt sich nicht vollständig aufklären. Die Außenseite wird durch die Substitution aller Hydroxygruppen eigentlich wesentlich hydrophober. Doch durch die sperrigeren Methylgruppen im Vergleich zum Wasserstoff-Atom kommt es am oberen Rand des Cyclodextrin-Moleküls zu sterischen Behinderungen, die durch Kippen der Glucose-Einheiten verringert werden. Außerdem kommt es zu Verdrehungen einzelner Glucose-Einheiten. Diese Faktoren führen zu der erhöhten Wasserlöslichkeit. Die Derivatisierung beeinflusst aber nicht nur die Wasserlöslichkeit sondern auch die Löslichkeit in organischen Lösemitteln. Aufgrund der hydrophoberen Außenseite sind die methylierten Derivate in Methanol, Ethanol und Dimethylsulfoxid gut löslich, während sich natürliches β-Cyclodextrin darin nahezu nicht lösen lässt. |
||||||||
Literatur:
|
||||||||
| | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |