|
Sind die Lösungen vorbereitet, kann der Versuch innerhalb von 10 – 15 Minuten durchgeführt werden. Es bieten sich Folgeversuche an (Austausch des Gastmoleküls und Dissoziation des Komplexes). |
||||
|
||||
| Die Entfärbung der Phenolphthalein-Lösung in den beiden Varianten kann nicht auf die Verschiebung des pH-Werts in den sauren Bereich zurückgeführt werden, denn die Suspension bzw. die Lösung ist nachweislich alkalisch (pH = 10 – 11). Bei Zugabe der magentafarbenen Phenolphthalein-Lösung zu β-Cyclodextrin bzw. zur β-Cyclodextrin-Lösung bildet sich ein Wirt-Gast-Komplex mit dem konusförmigen β-Cyclodextrin, das das Gastmolekül Phenolphthalein in seinem Hohlraum über van-der-Waals-Wechselwirkungen komplexiert. Da die im sauren und neutralen vorliegende Molekülstruktur nichtionisch und damit weniger polar ist, könnte vermutet werden, dass das Phenolphthalein in dieser Form komplexiert wird, womit auch die Entfärbung der Lösung erklärt wäre. | ||||
 |
||||
| Abb. 2.14: Molekülstrukturen von Phenolphthalein bei pH < 8,5 und pH > 9 | ||||
| Doch die Aufnahme von UV-VIS-Spektren der verschiedenen Stoffe und des Komplexes haben gezeigt, dass das Phenolphthalein im Cyclodextrin in der Dianion-Form vorliegt. Bei der Bildung des Wirt-Gast-Komplexes wird das Phenolphthalein-Dianion durch Ausbildung von drei Wasserstoffbrücken-Bindungen zum Cyclodextrin-Molekül komplexiert. Bei diesem Komplex sind also nicht die van-der-Waals-Kräfte zwischen dem Gast-Molekül und der unpolaren Kavität des Cyclodextrins wesentliche Kräfte. | ||||
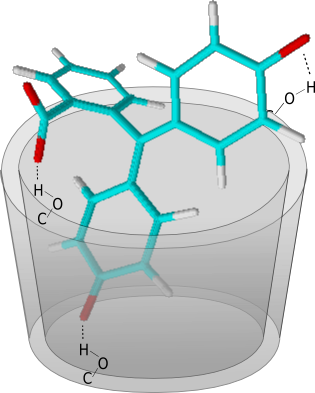 |
||||
| Abb. 2.15: Schematische Darstellung der Wasserstoffbrückenbindungen zwischen dem β-Cyclodextrin-Molekül und dem Phenolphthalein-Dianion | ||||
| Aufgrund dieser zwischenmolekularen Wechselwirkungen wird das Phenolphthalein-Molekül um das zentrale Kohlenstoffatom stärker verdrillt. Dadurch wird die Delokalisierung des konjugierten π-Elektronensystems beeinträchtigt, was sich im Verschwinden der Farbigkeit bemerkbar macht. | ||||
Die Beobachtung, dass sich Phenolphthalein trotz der alkalischen Lösung bei Anwesenheit von Cyclodextrin entfärbt, ist Grundlage einer analytischen Methode für die Bestimmung des Cyclodextrin-Gehalts. In UV-VIS-Spektren kann über die Absorption bei 550 nm, bei der das Phenolphthalein-Dianion die stärkste Absorptionsbande aufweist, der Gehalt an Cyclodextrin bestimmt werden.
Über die Entfärbung der Phenolphthalein-Lösung werden in weiteren Versuchen Cyclodextrine nachgewiesen. So können Textilerfrischer mit Hilfe dieses einfachen Versuchs (Gewinnung aus Textilerfrischern und Nachweis von Cyclodextrinen) auf Cyclodextrine getestet werden. Außerdem wird der mit Cyclodextrinen ausgerüstete Baumwollstoff auf diese Weise getestet (Cyclodextrine in der Textilausrüstung). Entfärbt sich die rotviolette Lösung auch noch dann, wenn die Stoffprobe mit Wasser gewaschen wurde, kann man sicher sein, dass die Cyclodextrin-Moleküle über das Ankermolekül kovalent an der Baumwollfaser gebunden sind. |
||||
|
||||
