 |
|
 |
Geschwindigkeit der Hydrolyse von Chlormethylsilanen |
 |
  1
Materialien, Chemikalien, Zeitbedarf 1
Materialien, Chemikalien, Zeitbedarf |
 |
- Stativ
- Stativklammern und Muffen
- Magnetrührplatte
- Magnetrührstäbchen
- Thermometer (bis 100 °C)
- Leitfähigkeitsprüfer
- Spannungsmeßgerät (3 V ~)
- Strommeßgerät (30 mA ~)
- regelbare Wechselspannungsquelle
- Stoppuhr
- 3 Bechergläser, 250 ml, hohe Form
- Becherglas, 25 ml
- 3 Reagenzgläser
- 3 passende Gummistopfen
- Reagenzglasständer
- Waage
- kleiner Erlenmeyerkolben
- 3 Pipetten (15 ml, 20 ml, 25 ml)
- Peleusball
- Chlortrimethylsilan (M), C, F
- Dichlordimethylsilan (D), Xi, F
- Trichlormethylsilan (T), Xi, F
- Salzsäure, c = 2 mol/l
Der gesamte Versuch bedarf ca. 35 Minuten. Dabei sind 20 Minuten für
die Vorbereitung mit Einstellung der Messapparatur, 11 Minuten für
die eigentlichen Hydrolysen und die restlichen Minuten für Umbau
und Zwischenreinigung angesetzt. |
 |
  2
Versuchsdurchführung und -beobachtung 2
Versuchsdurchführung und -beobachtung |
 |
Da die Chlormethylsilane sehr leicht
hydrolysieren und dabei Chlorwasserstoff entsteht, ist der Versuch unter
dem Abzug durchzuführen.
Schutzbrille, Gummihandschuhe und Laborkittel verstehen sich von selbst.
Drei Bechergläser werden mit je 50 ml Wasser beschickt. Die Chlormethylsilane
werden in drei Reagenzgläsern bereit gestellt: In das erste Reagenzglas
werden 10,86 g Chlortrimethylsilan, in das zweite 6,45 g Dichlordimethylsilan
und in das dritte 4,98 g Trichlormethylsilan gegeben. Die Reagenzgläser
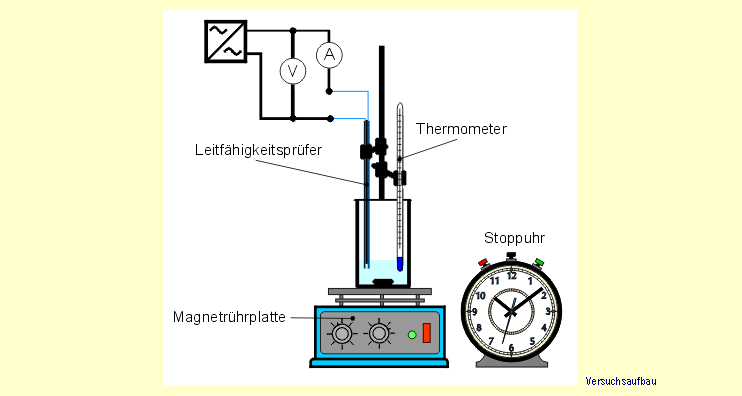
werden verschlossen. Die Messvorrichtung wird gemäß der folgenden
Versuchsskizze unter dem Abzug aufgebaut. |
 |
  Bevor
die einzelnen Messungen durchgeführt werden, wird der Leitfähigkeitsprüfer
in Salzsäure, c = 2 mol/l, getaucht und die Spannung so eingestellt,
dass ein brauchbarer Strommesswert (von 10 mA bis 15 mA) ablesbar ist, ohne
dass eine Gasbildung an den Elektroden erkennbar ist. Der Leitfähigkeitsprüfer
wird gereinigt und in das Wasser für die erste Hydrolyse gehängt.
Dann wird der Rührer auf eine mittlere Geschwindigkeit gestellt. Gleichzeitig
mit der Zugabe des Chlortrimethylsilans wird die Stoppuhr gestartet und
die Änderung der Stromstärke verfolgt. Ist die Stromstärke
über ca. 60 s konstant, wird der Versuch beendet. Dabei wird die eingestellte
Spannung am Stromversorgungsgerät nicht verändert. Bevor
die einzelnen Messungen durchgeführt werden, wird der Leitfähigkeitsprüfer
in Salzsäure, c = 2 mol/l, getaucht und die Spannung so eingestellt,
dass ein brauchbarer Strommesswert (von 10 mA bis 15 mA) ablesbar ist, ohne
dass eine Gasbildung an den Elektroden erkennbar ist. Der Leitfähigkeitsprüfer
wird gereinigt und in das Wasser für die erste Hydrolyse gehängt.
Dann wird der Rührer auf eine mittlere Geschwindigkeit gestellt. Gleichzeitig
mit der Zugabe des Chlortrimethylsilans wird die Stoppuhr gestartet und
die Änderung der Stromstärke verfolgt. Ist die Stromstärke
über ca. 60 s konstant, wird der Versuch beendet. Dabei wird die eingestellte
Spannung am Stromversorgungsgerät nicht verändert.
Der Leitfähigkeitsprüfer und das Thermometer werden gereinigt
und der Versuchsaufbau wird mit dem nächsten Becherglas mit Wasser
wieder hergestellt. Die zweite Messung wird mit Dichlordimethylsilan durchgeführt.
In beiden Fällen trübt sich das Reaktionsgemisch bei der Zugabe
des Chlormethylsilans, die Stromstärke nimmt zügig zu und erreicht
bereits nach ca. 25 s einen konstanten Wert. Bei längerem Stehenlassen
trennen sich in beiden Fällen zwei flüssige Phasen voneinander
ab.
Trichlormethylsilan wird ohne Leitfähigkeitsprüfer hydrolysiert,
da dieser beschädigt werden könnte. Die Hydrolyse erfolgt hier
ebenso wie die nachfolgende Kondensation augenblicklich beim Eingießen
des Trichlormethylsilans. Dabei fällt ein Silicon als Feststoff aus,
der die Kontakte des Leitfähigkeitsprüfers verkleben würde.
Die Reaktionsbedingungen stellen sich in der Zusammenfassung wie folgt
dar:
- Chlortrimethylsilan: 10,86 g + 50 g Wasser
- Dichlordimethylsilan: 6,45 g + 50 g Wasser
- Trichlormethylsilan: 4,98g + 50 g Wasser (hier keine Messung des Stroms)
- Raumtemperatur: 295 K
- Messspannung: U = 1 V
- Messstrom in HCl (aq), c = 2 mol/l: I
= 10 mA
  Die
erhaltenen Messwerte sind in der folgenden Tabelle dargestellt: Die
erhaltenen Messwerte sind in der folgenden Tabelle dargestellt:
|
 |
Zeit in s |
Chlortrimethylsilan
Strom in mA |
Dichlordimethylsilan
Strom in mA |
5 |
6 |
10 |
10 |
9 |
10,5 |
15 |
10 |
10,5 |
20 |
10,5 |
10,5 |
25 |
10,5 |
10,5 |
30 |
10,5 |
10,5 |
60 |
10,5 |
10,5 |
120 |
10,5 |
10,5 |
180 |
10,5 |
10,5 |
240 |
10,5 |
10,5 |
300 |
10,5 |
10,5 |
|
 |
  3
Versuchsauswertung 3
Versuchsauswertung
|
 |
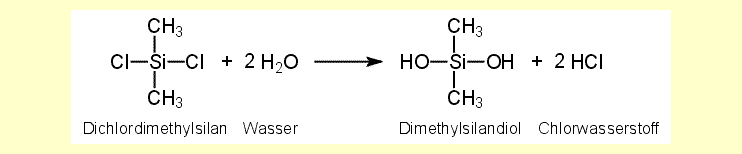
| Alle drei Chlormethylsilane sind gegen Wasser
nicht beständig und hydrolysieren zu Methylsilanolen und Chlorwasserstoff.
Als Beispiel sei hier die Reaktionsgleichung für Dichlordimethylsilan
angegeben: |
 |
Die sich bildenden Chlorid- und Hydronium-Ionen
bewirken, dass die Stromstärke proportional zu ihrer Konzentration
ansteigt. Die Änderung der Stromstärke gibt also eine direkte
Auskunft über das Fortschreiten der Reaktion und kann zur Ermittlung
der Reaktionsgeschwindigkeit heran gezogen werden. Die im Versuch eingesetzten
Stoffmengen sind so berechnet, dass bei vollständiger Hydrolyse im
jeweiligen Becherglas Salzsäure der Konzentration c = 2 mol/l vorliegt.
Die graphische Darstellung der Messwerte ergibt folgende Strom - Zeit Kurven: |
 |
 |
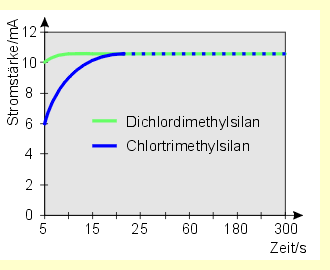 |
Es ist deutlich zu erkennen, dass die Hydrolyse
von Chlortrimethylsilan etwas langsamer als die von Dichlordimethylsilan
erfolgt, jedoch immer noch relativ rasch (sie ist nach 25 s abgeschlossen).
Die amperometrischen Messungen geben nicht Auskunft über die
Geschwindigkeit mit der die Kondensation der Silanole, die bei der
Hydrolyse entstehen, erfolgt. Darüber erhält man einen qualitativen
Eindruck anhand der Phasentrennung nach der Hydrolyse (vgl. weiter
oben).
Während bei dem monofunktionellen Trimethylsilanol die Kondensation
bereits bei dem niedrigviskosen Hexamethyldisiloxan endet, bilden
sich in den beiden anderen Fällen makromolekulare, hochviskose
bzw. feste Produkte. |
|
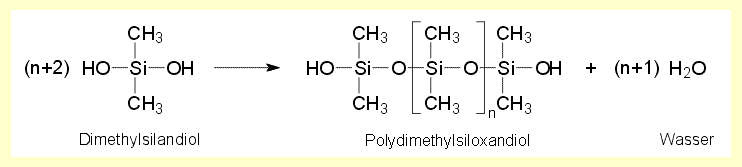
| Die Reaktionsgleichung der Kettenbildung
bei der Kondensation des Dimethylsilandiols lautet: |
 |
 |
  4
Tipps und Anmerkungen 4
Tipps und Anmerkungen
|
 |
- Aufgrund der erhaltenen Ergebnisse kann nur die Hydrolyse von Chlortrimethylsilan
für amperometrische Messungen empfohlen werden, weil die beiden
anderen Chlormethylsilane zu schnell hydrolysieren.
- Die strukturelle Analogie zwischen Chlortrimethylsilan und 2-Chlor-2-Methylpropan
(tert.-Butylchlorid) gibt Anlass, den hier beschriebenen Versuch mit
den beiden Chlorderivaten durchzuführen um die nucleophile Substitution
am Si-Atom mit der am C-Atom zu vergleichen.
- Alle hier beschriebenen Hydrolysen verlaufen exotherm. Die Temperaturmessung
ergibt einen Anstieg auf ca. 40 °C, wenn man bei Raumtemperatur
startet.
- Ein Teil des Hydrolyseproduktes von Dichlordimethylsilan kann nach
kurzer Alterung in dem Versuch "Abbrennen
von flüssigen Siliconen" weiter verwendet werden.
- Die Produkte der Dichlordimethylsilan-Hydrolyse eignen sich gut für
den Versuch "Viskosität von Siliconölen",
besonders dann, wenn Produktproben aus verschiedenen Ansätzen vorliegen,
die längere Zeit gestanden sind.
|
 |
  5
Ergänzende Sachinformationen 5
Ergänzende Sachinformationen
|
 |
| Angesichts der herausragenden Bedeutung
der Hydrolyse und nachfolgenden Kondensation von Chlormethylsilanen bei
der Synthese von Siliconen sollten diese einfachen und aussagekräftigen
Versuche auch in der Lehre, in Experimentalvorlesungen und Praktika an der
Universität, aber auch in der Sekundarstufe II Einzug finden. In der
hier beschriebenen Form ergänzen sie die im unten angegebenen Lehrbuch
dargestellten Inhalte zur nucleophilen Substitution und zur technischen
Herstellung von Siliconen. |
 |
  6 Literatur 6 Literatur |
 |
| M. Tausch, M. von Wachtendonk (Hrsg.), CHEMIE
S II, STOFF-FORMEL-UMWELT, C.C. Buchner, Bamberg (1993), (1998), S. 337f |
 |
  | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |
|



