|
||||||||||||
Silicone als Antischaummittel |
Insgesamt sollte für die folgenden Versuche ca. eine Stunde Versuchszeit einkalkuliert werden. |
| Variante a: Zwei Schnappdeckelgläschen werden zu je 2/3 mit Wasser gefüllt und mit einigen Tropfen Spülmittel versetzt. Nach dem Verschließen wird kräftig geschüttelt. Es wird beobachtet, wie sich der Schaum im Laufe der Zeit verändert. Bei der Zugabe von Spülmittel bilden sich klare Lösungen. Beim Schütteln entsteht jeweils im oberen Drittel des Schnappdeckelglases Schaum. Dieser besteht zuerst aus kleinen kugelförmigen Blasen, welche sich mit zunehmender Zeit zu größeren Polyederblasen vereinigen. Nun lässt man eines der Schnappdeckelgläser mit Schaum als Vergleichsprobe stehen und gibt in das zweite einen Tropfen der Antischaumemulsion AS-EM SRE aus dem WACKER-Schulversuchskoffer hinzu. Man beobachtet den Schaum. Bei Zugabe der Antischaumemulsion löst sich Schaum sehr schnell auf. Dabei ist ein Knistern (entweichende Luft) zu hören. Es bildet sich eine leicht trübe Lösung. Beim nochmaligen Schütteln bildet sich erneut etwas Schaum, der jedoch sofort wieder zusammen fällt. |
 |
Man füllt eine mittelgroße Glasschale mit Wasser und legt vorsichtig eine unbehandelte dünne Büroklammer (oder Nähnadel) auf die Oberfläche des Wassers. Anschließend gibt man mit einer Pipette am Rand der Glasschale einige Tropfen Wasser hinzu und beobachtet die Klammer. Beim Zufügen von Wasser schwimmt die Büroklammer weiterhin auf der Wasseroberfläche. Danach fügt man einige Tropfen der hergestellten Tensidlösung
aus Variante a hinzu. Bei der Zugabe der Tensidlösung kann man beobachten
wie die Büroklammer langsam tiefer in die Oberfläche des Wassers
einsinkt, bis sie plötzlich ganz untergeht. |
 |
In einem Reagenzglas werden 2 ml Wasser und 0,5 ml Olivenöl kräftig durchgeschüttelt. Das Reagenzglas wird in den Ständer gestellt und die Entmischung beobachtet. Die Mischungsversuche werden mit zwei weiteren Proben wiederholt, in die man etwas Tensidlösung aus Variante a bzw. etwas Tensid- und Antischaumlösung aus Variante a hinzufügt. Beim Schütteln bilden sich gelbliche Emulsionen. Ohne Tensidlösung entmischt sich die Emulsion schnell wieder und es entsteht eine Öl- und eine Wasserphase (vgl. Foto oben rechts - linkes Reagenzglas). Mit Tensidlösung bleibt die Emulsion länger bestehen und es tritt keine merkliche Entmischung auf (mittleres Reagenzglas). Gleiches ist bei der Lösung mit Antischaummittel zu beobachten. Im Unterschied zur reinen Tensidlösung bildet sich aber fast kein Schaum (rechtes Reagenzglas). |
| Hinweis: Die
theoretischen Grundlagen zur Wirkungsweise der Tenside und zur Schaumildung
werden in Teil 5 Ergänzende Sachinformationen erörtert.
Dieser Teil sollte ggf. vor den folgenden Auswertungen der Varianten a bis
c gelesen werden.
Variante a: |
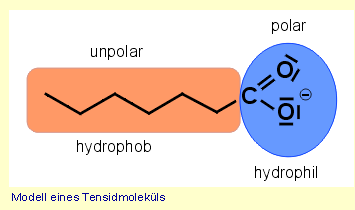
Tenside stabilisieren aufgrund ihrer Struktur durch Bildung von Fett/Tensid-Micellen die Öl/Wasseremulsion. Deshalb sind diese Emulsionen wesentlich beständiger als die reine Öl/Wasseremulsion. Aufgrund dieses Effekts (Bildung von Fett/Tensid-Micellen) und der Herabsetzung der Oberflächenspannung des Wasser bilden Tenside den wichtigsten Grundbaustein für Waschmittel. Die Tensidlösung mit Antischaummittel verhält sich bis auf die geringere Schaumbildung genauso wie die Tensidlösung. Das ist auf das sehr gute Spreitungsvermögen des Silicon-Entschäumers zurückzuführen, der die Tensid-Teilchen aus den Häuten der Schaumblasen verdrängt und somit ihren Kollaps verursacht. |
|
| Diese Versuche dienen der Untersuchung des
Einflusses von Tensiden auf die Oberflächenspannung des Wassers und
die damit verbundenen Effekte wie Schaumbildung, Emulsionsfähigkeit
u.a. Damit zusammenhängend wird als wichtige praktische Anwendung für
die Wirkung von Siliconölen als Antischaummittel untersucht. So werden Siliconöle beispielsweise bei Kühen eingesetzt, die unter Blähsucht leiden. Bei der Blähsucht handelt es sich um ein Auftreiben des Bauches, das durch übermäßige Schaumbildung verursacht wird. Schuld an der übermäßigen Schaumbildung sind sapoinhaltige Pflanzen, die mit dem Wasser und dem Darmgas einen Schaum bilden. Gerade Silicone bieten sich hier als Medikamente an, da sie bis auf wenige Ausnahmen keinerlei toxischen Eigenschaften besitzen. Zur Struktur und Wirkungsweise von Tensiden |
| Emulsionen werden durch Tenside stabilisiert, Schmutzteilchen aus Fett oder Öl werden von Oberflächen abgeführt und in der flüssigen Phase emulgiert bzw. dispergiert (vgl. Skizzen a und b). |
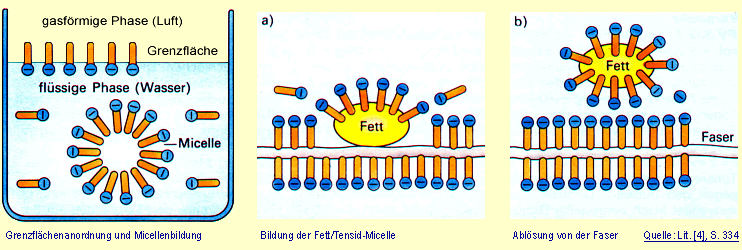 |
Durch die Anreicherung der Wasseroberfläche mit Tensid-Teilchen wird diese jedoch immer "luftähnlicher", was zur Entwicklung von Schaumblasen (Kugelschaum - vgl. Skizze unten links) führt. Zunehmendes Abfließen der Flüssigkeit lässt die Blasen immer dünner werden, die Gasblasen rücken enger zusammen, deformieren sich gegenseitig und werden zu Polyedern (Polyederschaum - vgl. Versuchsbeschreibung, Variante a) bis sie schließlich zusammenfallen. Die Luftblasen bleiben jedoch stabil, falls das Tensid ein vollständiges Ablaufen der Flüssigkeit aus der Lamelle verhindert. Es gibt jedoch Anwendungen der Tenside, bei denen ihre Neigung zur Schaumbildung eher unerwünscht ist. Bei modernen Waschmaschinen ist die Schaumunterdrückung mitentscheidend für das Waschergebnis. Siliconöle wirken als Antischaummittel. Antischaummittel zeichnen sich durch eine niedrige Oberflächenspannung, schlechte Löslichkeit im zu entschäumenden Medium und einen positiven Eindring- und Spreitungskoeffizienten aus. Die Teilchen (Moleküle) des Entschäumers verdrängen die Tensidmoleküle von der Oberfläche der Lamelle und ersetzen sie durch einen neuen Film mit geringerer Oberflächenspannung und geringeren Kohäsionskräften (vgl. Skizze unten rechts). |
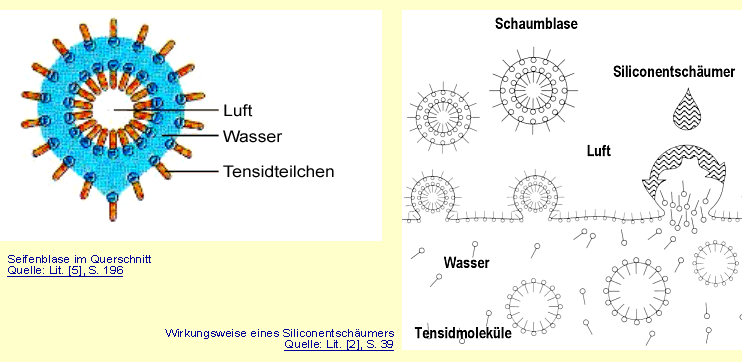 |
| Die Wirkung kann durch hydrophobe Festkörper noch verstärkt werden. Hierbei dient die Entschäumerflüssigkeit als Transportmittel, um die Feststoffteilchen in die Schaumlamelle zu bringen. Dort wirken sie als Fremdkörper, die einerseits die Tensidmoleküle absorbieren und andererseits die Kohäsionskräfte vermindern. Als Festkörper ist beispielsweise hochdisperse Kieselsäure bei Siliconölen sehr gut geeignet. |
|