 |
5. Wirt-Gast-Komplex aus β-Cyclodextrin und Iod und Nachweisreaktionen |
 |
  1
Materialien, Chemikalien, Zeitbedarf 1
Materialien, Chemikalien, Zeitbedarf |
 |
- Waage
- Spatel
- Becherglas (150 mL)
- Heizplatte mit Magnetrührer
- Rührfisch
- Messzylinder
- Thermometer
- Saugflasche mit Gucoring
- Büchnertrichter
- Filterpapier
- Wasserstrahlpumpe
- Reagenzgläser
- Reagenzglasständer
- Gasbrenner
- Iod Xn, N
- Kaliumiodid
- β-Cyclodextrin
- destilliertes Wasser
- Heptan F, Xn, N
- Stärke-Lösung
Für die Herstellung des Komplexes müssen ca. 20 Minuten anberaumt werden. Nach dem Trocknen braucht man für die Nachweisreaktionen nur wenige Minuten. |
 |
  2
Versuchsdurchführung und -beobachtung 2
Versuchsdurchführung und -beobachtung |
 |
Man stellt eine Lösung aus 0,25 g Iod, 1,65 g Kaliumiodid und 60 mL Wasser her. Die Lösung wird mit 0,5 g β-Cyclodextrin versetzt und für zehn Minuten bei 80°C gerührt. Man sollte darauf achten, dass sich das gesamte Iod gelöst hat. Nachdem die Lösung auf Raumtemperatur abgekühlt ist, saugt man den Niederschlag ab. Der Feststoff wird getrocknet und dann folgenden Untersuchungen unterzogen:
a) Man gibt zu einer Spatelspitze des Feststoffes einige Milliliter Stärke-Lösung und schüttelt.
b) Eine Spatelspitze des Feststoffes wird mit Heptan versetzt und geschüttelt.
c) Man erhitzt eine kleine Portion des Feststoffes in einem Reagenzglas mit dem Gasbrenner. Anschließend gibt man etwas Stärke-Lösung hinzu.
d) Eine Spatelspitze des Feststoffes wird mit Wasser versetzt und kräftig geschüttelt. Dann überschichtet man die wässrige Lösung mit Heptan und schüttelt nach einiger Zeit.
Man überprüft die Beobachtungen nach einigen Minuten.
Aus der tiefbraun gefärbten Lösung fällt beim Abkühlen ein Niederschlag aus. Beim Abnutschen erkennt man dunkelbraun gefärbte, nadelförmige Kristalle. |
 |
Abb. 2.9: Kristalle von b-Cyclodextrin und des Iod-b-Cyclodextrin-Komplexes unter dem Mikroskop mit vierfacher Vergrößerung |
 |
a) Die Kristalle lösen sich nicht sichtbar. Die Stärke-Lösung bleibt farblos. Erst nachdem mehr als fünf Minuten vergangen sind, ist eine Blaufärbung der Lösung zu erkennen.
b) Es ist zunächst keine Verfärbung der Heptanphase zu beobachten, erst allmählich färbt sich das Heptan ganz leicht violett (wesentlich weniger intensiv als bei d)).
c) Beim Erhitzen steigt ein violett gefärbter Dampf im Reagenzglas auf. Bei Zugabe von Stärke-Lösung färbt sich die Lösung sofort tiefblau.
d) Die Heptan-Phase bleibt zunächst farblos. Erst nach einiger Zeit lässt sich nach dem Schütteln eine Violettfärbung der Heptan-Phase beobachten. |
 |
Komplex mit Stärke-Lösung versetzt |
Komplex mit Heptan versetzt |
Komplex erhitzt und mit Stärke-Lösung versetzt |
Komplex mit Wasser und Heptan versetzt |
|
 |
| Abb. 2.10: Nachweisreaktionen unmittelbar nach Zugabe der Reagenzien |
 |
 |
Nachweis von Iod mit Stärke-Lösung |
Keine Verfärbung der Heptan-Phase |
Nachweis von Iod mit Stärke-Lösung |
Nachweis von Iod durch Verfärbung der Heptan-Phase |
|
| Abb. 2.11: Nachweisreaktionen nach acht Minuten |
 |
|
  3
Versuchsauswertung 3
Versuchsauswertung
|
 |
| Der negative Ausfall der Iod-Stärke-Reaktion in dem ersten Reagenzglas deutet darauf hin, dass in dem Feststoff kein freies Iod vorliegt. Die Kristalle bestehen aus einem Wirt-Gast-Komplex, indem Iod-Moleküle in der Kavität des Cyclodextrin-Moleküls eingeschlossen sind. Die Kräfte, die den Komplex aus dem unpolaren Iod und dem β-Cyclodextrin stabilisieren, beruhen auf van-der-Waals-Kräften zwischen Iod-Molekülen und dem hydrophoben Innenraum des β-Cyclodextrin-Moleküls. Die treibenden Kräfte der Bildung des Komplexes sind aber auf weitere Faktoren zurückzuführen. Ein wesentlicher Faktor ist der Austausch der sich in der Cyclodextrin-Kavität befindlichen Wassermoleküle durch das Gastmolekül. |
 |
|
α-Cyclodextrin |
β-Cyclodextrin |
γ-Cyclodextrin |
Hydratbildung |
α-CD * 6 H2O |
β-CD * 11 H2O |
γ-CD * 15,7 H2O |
Anzahl der Wasser-Moleküle in der Kavität |
1 – 2 |
6 |
8,8 |
|
 |
| Tab. 2.3: Hydratbildung der Cyclodextrine |
 |
| Diese Wassermoleküle besitzen eine relativ hohe Enthalpie, da es keine Wechselwirkungen zwischen den polaren Wassermolekülen und dem apolaren Innenraum der Cyclodextrin-Moleküle gibt. Der Austausch der Wassermoleküle durch ein weniger polares Gastmolekül verläuft also exergonisch. Die Entropiezunahme begünstigt diesen Vorgang. Zudem können sich in der Cyclodextrin-Kavität van-der-Waals-Kräfte zu den unpolareren Iod-Molekülen ausbilden. Eine Dissoziation des Iod-β-Cyclodextrin-Komplexes erreicht man zum einen durch Erhitzen des Feststoffes. Das ausgetriebene Iod erkennt man an der Farbe des Dampfes und an dem positiven Ausfall der Iod-Stärke-Reaktion. Auch durch Zugabe von Wasser erreicht man die allmähliche Dissoziation. Der Konzentrationsunterschied des Gastes im Komplex und in der Lösung führt zu der Dissoziation des Komplexes, bis sich ein Gleichgewicht eingestellt hat. An der Bildung der blauen Einschlussverbindung bzw. an der Färbung der Heptanphase kann man erkennen, dass der Komplex nach einiger Zeit dissoziiert. Bei Zugabe von Heptan ist die Dissoziation des Komplexes kaum zu beobachten. |
 |
  4
Tipps und Anmerkungen 4
Tipps und Anmerkungen
|
 |
| Um klare Ergebnisse zu erhalten, muss der aus Lösung hergestellte Komplexe zunächst getrocknet werden, da sonst die Iod-Stärke-Reaktion unmittelbar nach Zugabe der Stärke-Lösung positiv ausfällt. Denn wie im Versuch gezeigt wird, benötigt man für die Dissoziation des Komplexes Wasser. Deshalb kann der Versuch nicht in einer Unterrichtsstunde durchgeführt werden. |
 |
  5 Ergänzende Sachinformationen 5 Ergänzende Sachinformationen |
 |
In diesem Versuch wird die Komplexbildung von Iod durch das Ausbleiben typischer Reaktionen des Gast-Moleküls wie z.B. die sehr empfindliche Iod-Stärke-Reaktion nachgewiesen. Dieser Methode bedient man sich auch im Versuch zur Komplexbildung von Salicylsäure.
Um die Wirt-Gast-Komplexbildung mit verschiedensten Gastmolekülen zu untersuchen, wendet man spektroskopische Methoden an. Dabei erhält man einen Beweis für die Komplexbildung aus NMR-Untersuchungen (nuclear magnetic resonance). Dazu vergleicht man 1H-NMR-Spektren des Cyclodextrins, des Gastmoleküls und des Komplexes in D2O. Aufgrund der Wechselwirkungen des Gastmoleküls mit dem Cyclodextrin-Molekül werden die Signale der Cyclodextrin-Wasserstoff-Atome im Vergleich zu den Signalen im Spektrum von reinem Cyclodextrin verschoben. Da nur die in der Kavität des Cyclodextrin-Moleküls liegenden Wasserstoff-Atome an den Kohlenstoff-Atomen 3 und 5 (siehe Abb. 2.12) einer chemischen Verschiebung unterliegen, können die Spektren schnell interpretiert und ausgewertet werden. Die Wasserstoff-Atome an der Cyclodextrin-Außenseite werden durch die Komplexbildung eines Gastmoleküls nicht beeinflusst. |
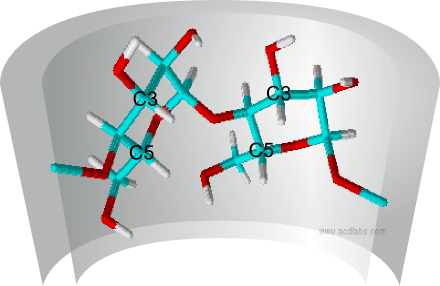 |
| Abb. 2.12: Blick auf zwei Glucose-Einheiten im β-Cyclodextrin und Markierung der innenliegenden Wasserstoff-Atome an den Kohlenstoffatomen 3 und 5 |
 |
| Handelt es sich bei den Gastmolekülen um gefärbte Stoffe, so kann auch die Aufnahme von UV-VIS-Spektren einen Aufschluss über die Bildung eines Wirt-Gast-Komplexes geben, da sich das Absorptionsspektrum des Gastmoleküls verändert. |
 |
  6 Literatur 6 Literatur |
 |
- Szejtli, J.; Pure Appl. Chem., 10, 2004, 76, 1825-1845
- Connors, K. A.; Chem. Rev., 1997, 97, 1325-1357
- Szejtli, J.; Osa, T.; Comprehensive Supramolecular Chemistry. Volume 3 Cyclodextrins, Elsevier Science Ltd. Oxford, 1996, S. 21-22
- Szejtli, J.; Osa, T.; Comprehensive Supramolecular Chemistry. Volume 3 Cyclodextrins, Elsevier Science Ltd. Oxford, 1996, S. 200
|
 |
  | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |



