Von
den Rohstoffen zu den Siliconen Von
den Rohstoffen zu den Siliconen
Das Element Silicium
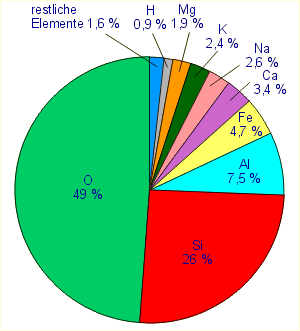
Das folgende Kuchendiagramm zeigt die Häufigkeit der Elemente in der
Erdkruste:
Das Element Silicium steht mit 26 % an zweiter Stelle der Häufigkeit der Elemente
in der Erdkruste. Obwohl es wesentlich häufiger vorkommt als Kohlenstoff
(Anteil 0,087 %), spielt es in der belebten Welt der Biomoleküle
keine wesentliche Rolle. Man kann aber sagen, dass Silicium den
Grundstoff der unbelebten Welt darstellt. Es tritt fast ausschließlich
in Kombination mit dem häufigsten Element (Sauerstoff) in Form von
Siliciumdioxid und Silikaten auf. Neben den verschiedenen Silikaten
(Salze der Kieselsäure) mit Magnesium-, Calcium- oder Eisenanteilen
trägt Siliciumdioxid in den Variationen Sand, Quarz und Kieselsteinen
wesentlich zum Aufbau der Erdkruste bei. Während Sande und Tonmineralien
schon seit altersher zu Kulturgegenständen verarbeitet wurden, gelang
es erst im Jahre 1824 dem Chemiker Berzelius das Element Silicium
in amorpher Form zu isolieren. Alle erwähnten Siliciumver- bindungen
enthalten als typisches Strukturelement ein Tetraeder, wobei Silicium
jeweils mit vier Sauerstoffatomen verbunden ist.
|
 |
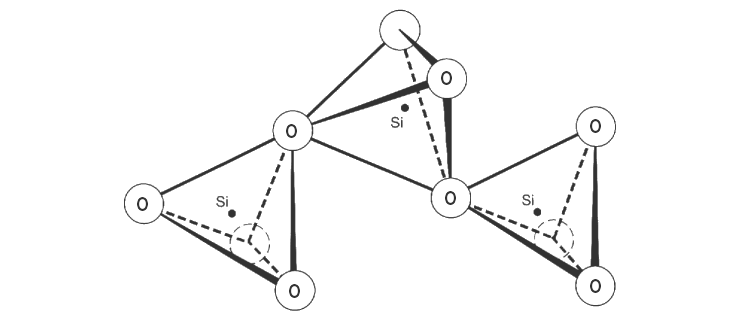 |
Strukturelemente des Siliciumoxids (Quarz) |
 |
Obwohl Silicium ebenso
wie Kohlenstoff in der vierten Hauptgruppe des Periodensystems steht,
unterscheiden sich beide Elemente wesentlich in ihrer Chemie. Kohlenstoff
bildet eine schier unerschöpfliche Palette von Verbindungen, während die
Analoga mit Silicium nicht existieren. Dies gilt sowohl für Verbindungen
in der Natur, als auch für synthetische. Um dieses Verhalten besser zu
verstehen, soll im folgenden auf die Unterschiede zwischen den beiden
Elementen (Kohlenstoff und Silicium) kurz eingegangen werden.
  Vergleich
der Elemente Kohlenstoff und Silicium: Vergleich
der Elemente Kohlenstoff und Silicium:
1. Elektronegativität
Kohlenstoff besitzt eine höhere Elektronegativität als Silicium
(C: 2,5; Si: 1,8).
2. Atomradien
C: 0,77 Å; Si: 1,15 Å
3. Elektronenkonfiguration
C: 1s2 2s2 2p2;
Si: 1s2 2s2 2p6 3s2 3p2
4. Bindigkeit mit Sauerstoff
Während Kohlenstoff dazu neigt, mit Sauerstoff Doppelbindungen
auszubilden, bildet Silicium dagegen sehr stabile Einfachbindungen aus.
Lediglich in einigen labilen Silanverbindungen kommt es zur Ausbildung
von Doppelbindungen. Verstanden werden kann dieses Verhalten mit Hilfe
des MO-Diagramms. Es kommt in der geringeren Energie für  Übergänge von Alkenen und Disilanen zum Ausdruck: Übergänge von Alkenen und Disilanen zum Ausdruck: 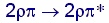 bei C ca. 6 eV, bei C ca. 6 eV,  bei Si ca. 3 eV
. bei Si ca. 3 eV
.
Neben der Vierbindigkeit ist Silicium aber auch dazu
befähigt, Verbindungen mit höheren oder niedrigeren Koordinationszahlen
einzugehen:
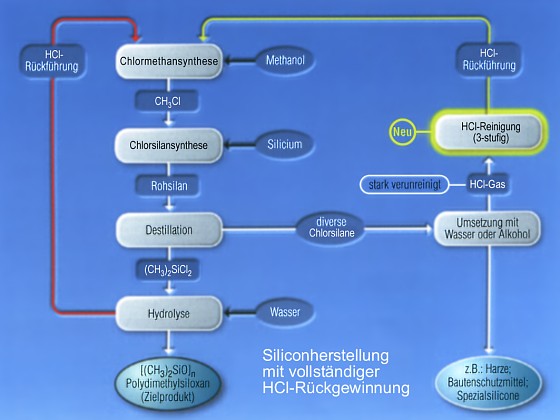
  Grobe
Skizzierung der industriellen Silicon-Synthese Grobe
Skizzierung der industriellen Silicon-Synthese
 |
 |
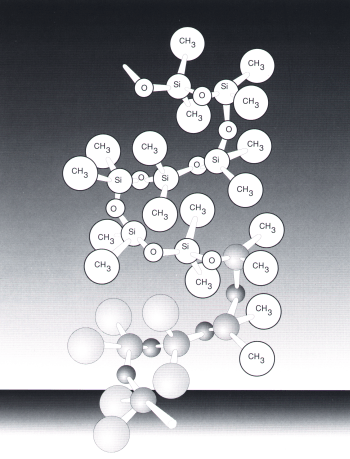
Wie die nebenstehende Abbildung eines Ausschnittes
eines linearen Siliconmoleküls zeigt, handelt es sich bei den Siliconen
um organisch modifizierten Quarz.
Für die Siliconsynthese werden die Rohstoffe
Sand, Kohle, Erdgas/Erdöl, Steinsalz, Luft und Wasser benötigt.
Aus Sand und Kohle wird
Rohsilicium gewonnen, das in einem kontinuierlichen Prozess zu
den gewünschten Siliconen weiterverarbeitet wird. Erdgas oder Erdöl
dienen dazu, Methanol herzustellen (Synthesegas), ein weiterer Ausgangsstoff
zur Siliconsynthese. Durch Elektrolyse von Steinsalzlösungen wird
Chlor gewonnen, das in Form von HCl dem Prozess zugeführt wird. Wie
der Produktionsprozess von Siliconen aussieht, zeigt schematisch
die untere Abbildung:
Im ersten Schritt wird Methanol mit HCl zu Chlormethan
umgesetzt (Chlormethansynthese). Anschließend gewinnt man durch
Reaktion von Chlormethan mit Silicium ein Gemisch von Rohsilanen
(Chlorsilansynthese). Diese werden durch Destillation getrennt,
wobei Dichlordimethylsilan (CH3)2SiCl2 dann durch Hydrolyse in Polydimethylsiloxan überführt wird. |
 |
 |
 |
|
Die anderen Silane werden alternativ auch mit Alkohol
zu Harzen, Bautenschutzmitteln oder Spezialsiliconen umgesetzt. Interessant
ist an dieser Arbeitsweise, dass der auftretende Chlorwasserstoff einen
Kreislauf bildet. Auf diese Weise wird nicht nur die Wirtschaftlichkeit
erhöht, sondern auch Ressourcen geschont und die Umwelt erheblich entlastet. |