|
||||||||||||
Brennbarkeit von Siliconen im Vergleich zu anderen Kunststoffen |
||||||
Zur Untersuchung der verschiedenen Kunststoffe sollte ein Zeitbedarf von 5 bis 7 Minuten je Probe einkalkuliert werden. |
||||||
Alle Versuche sollten nach Möglichkeit im Abzug durchgeführt werden. PVC darf nur im Abzug verbrannt werden! a) Ein Teil der Kunststoffprobe wird mit einer Tiegelzange für kurze Zeit in die Randzone einer heißen Brennerflamme gehalten. Anschließend wird beobachtet, ob der Kunststoff weiter brennt, welche Farbe die Flamme hat, ob sich Ruß oder Schwaden bilden, ob die Flamme knistert und ob das Material schmilzt. b) Zur weiteren Untersuchung erhitzt man einen weiteren Teil der jeweiligen Kunststoffprobe in einem Reagenzglas und prüft vorsichtig den Geruch. Mit feuchtem Indikatorpapier stellt man fest, ob die in der Reaktion entstehenden Zersetzungsprodukte sauer, alkalisch oder neutral reagieren. c) Schließlich überprüft man, inwiefern sich der Kunststoff thermoplastisch verhält. Dazu erwärmt man eine weitere Probe des Kunststoffs mit einer Tiegelzange vorsichtig über kleiner Bunsenbrennerflamme und versucht, die warme Probe zu verbiegen. |
||||||
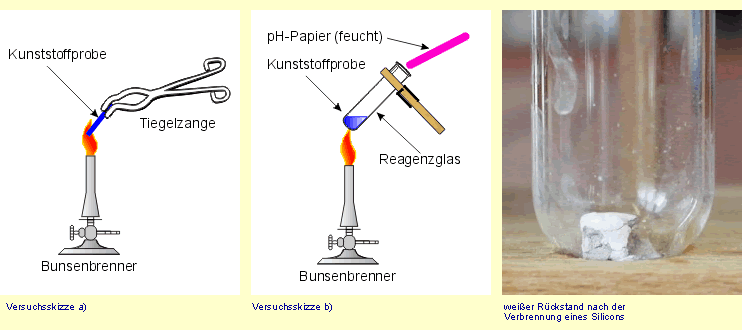 |
||||||
Bei mehreren reproduzierbaren Referenzversuchen wurden für die verschiedenen Kunststoffproben folgende Beobachtungen notiert: |
||||||
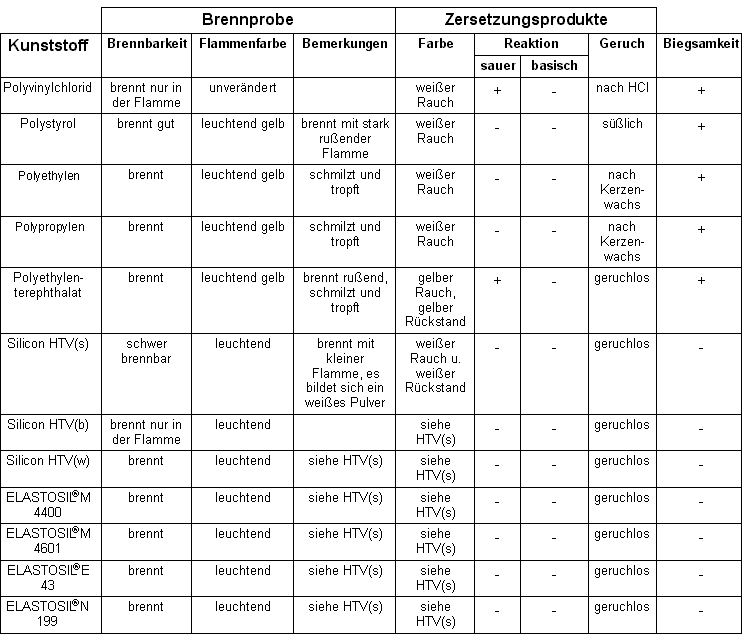 |
||||||
| Die unterschiedlichen Beobachtungen beim
Verbrennen der Kunststoffproben können mithilfe der elementaren Zusammensetzung
und des molekularen Aufbaus der verschiedenen Kunststoffe erklärt werden. Wie bei den meisten organischen Verbindungen entstehen auch beim Verbrennen von organischen Kunststoffen hauptsächlich Kohlendioxid und Wasser als Produkte, wie man anhand der nachfolgenden Reaktionsgleichung für die Verbrennung von Polyethylen erkennen kann: |
||||||
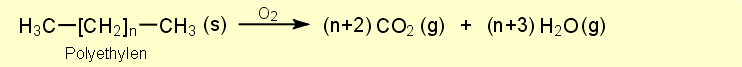 |
||||||
Zusätzlich zu Kohlendioxid und Wasser können bei manchen
herkömmlichen Kunststoffen je nach Zusammensetzung auch weitere toxische
und nicht toxische Verbrennungsprodukte entstehen. Das folgende Reaktionsschema für die vollständige Verbrennung eines Silicons zeigt, dass sich in diesem Fall auch Siliciumdioxid bildet: |
||||||
|
||||||
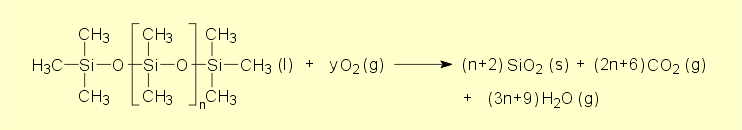 |
||||||
| Die Beobachtungen bei der Verbrennung der
Silicone korrelieren sehr gut mit der oben angegebenen Reaktionsgleichung
für die Verbrennung von Siliconöl. Die entstandene weiße
Substanz ist pyrogenes Siliciumdioxid, das sich bei der Verbrennung bildet.
Der weiße Rauch ist ebenfalls fein verteiltes Siliciumdioxid. Bei
der Verbrennung oder starken Erhitzung von Siliconen entstehen keine basisch
oder sauer reagierenden Zersetzungsprodukte. In den Versuchen kann festgestellt werden, dass sich Silicone viel schwerer als organische Kunststoffe anzünden lassen, aber dann dennoch gut brennen. Die Aktivierungsenergie ist also sehr hoch, bei der Verbrennung wird aber auch viel Wärme frei. Dieses Verhalten kann mit den sehr stabilen Si-C und Si-O Bindungen (daher hohe Aktivierungsenergie) und den hohen Bildungsenthalpien von SiO2 und CO2 (daher viel Verbrennungswärme) erklärt werden. Durch Zusätze zum Siliconkautschuk (TiO2, Platin- oder Aluminiumverbindungen) entstehen besonders schwer brennbare Materialien, die so eingestellt werden können, dass die Flamme nach kurzer Zeit wieder verlischt. Die Unterschiede im thermoplastischen Verhalten (vgl. die Spalte "Biegsamkeit" in der Tabelle mit den Versuchsergebnissen) können mit der Struktur der untersuchten Kunststoffe erklärt werden. Die untersuchten organischen Kunststoffe gehören alle zur Klasse der Thermoplaste. Diese bestehen aus linearen oder verzweigten Makromolekülen (siehe Abbildung unten), die untereinander mehr oder weniger starke intermolekulare Wechselwirkungen ausüben. Beim Erwärmen können ganze Moleküle oder Teile davon aneinander vorbei gleiten, weil die Bewegung der Teilchen insgesamt zunimmt und weil es zwischen den Molekülen keine Vernetzung durch chemische Bindungen gibt. Der Kunststoff wird dabei weicher und formbar. Beim Erkalten bleibt er in dieser Form. Im Gegensatz zu den untersuchten organischen Kunststoffen sind die untersuchten Silicone Elastomere oder Duroplaste (vgl. Abbildungen unten). Da hier die Makromoleküle über chemische Bindungen miteinander verknüpft sind, verhalten sich diese Silicone nicht thermoplastisch. |
||||||
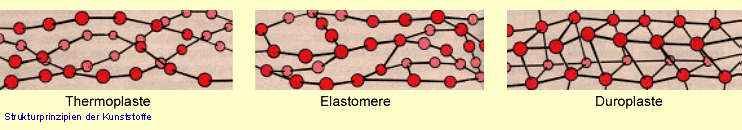 |
||||||
|
||||||
|
||||||
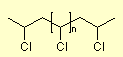 genannt,
welches in letzter Zeit als umweltbelastender Kunststoff ins Gerede gekommen
ist, da es unter Freisetzen von Chlorwasserstoff und anderen giftigen
Chlorverbindungen verbrennt. (
genannt,
welches in letzter Zeit als umweltbelastender Kunststoff ins Gerede gekommen
ist, da es unter Freisetzen von Chlorwasserstoff und anderen giftigen
Chlorverbindungen verbrennt. (