|
||||||||||||
Hydrolyse von Chlormethylsilanen |
||||
Der gesamte Versuch dauert etwa 15 Minuten, wovon 5 Minuten zur Vorbereitung, 3 Minuten zur Hydrolyse und 3 Minuten zum pH-Test benötigt werden. Die restliche Zeit wird zur Aufbereitung des Siliconharzpulvers benötigt. |
||||
| Da die Chlormethylsilane sehr leicht
hydrolysieren und dabei Chlorwasserstoff entsteht, ist der Versuch unter
dem Abzug durchzuführen. Schutzbrille, Gummihandschuhe und Laborkittel verstehen sich von selbst. Im Abzug werden drei Reagenzgläser mit 6 ml, 12 ml und 18 ml Wasser
beschickt. In drei anderen Reagenzgläsern werden je 2 ml der verschiedenen
Chlormethylsilane gegeben. Danach wird wie folgt verfahren:
|
||||
|
||||
Alle drei Chlormethylsilane sind gegenüber
Wasser nicht beständig und hydrolysieren zu Methylsilanolen und Chlorwasserstoff.
Als Beispiel sei hier die Reaktionsgleichung für Dichlordimethylsilan
angegeben: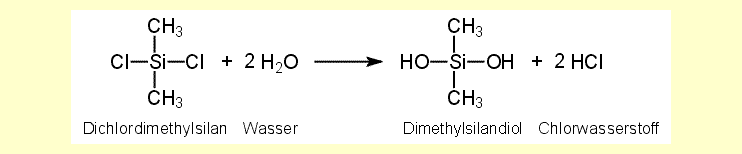 Die Methylsilanole kondensieren sofort zu größeren Molekülen. Bei dem monofunktionellen Trimethylsilanol endet die Kondensation bereits unter Bildung von Hexamethyldisiloxan, einer Siliciumverbindung, deren Moleküle ähnlich aufgebaut sind, wie die Moleküle eines Ethers. Hexamethyldisiloxan ist der einfachste Vertreter der Familie der Siliconöle und eine niedrig viskose Flüssigkeit mit relativ hohem Dampfdruck. Dimethylsilandiol kondensiert zu größeren Molekülen,
die kettenförmig oder ringförmig aufgebaut sein können.
Es handelt sich dabei um Polydimethylsiloxane, oder kurz Silicone. Je
länger diese Ketten sind, desto viskoser ist das Produkt. Die Bildung
von kettenförmigen Silicon-Makromolekülen erfolgt nach folgendem
Schema: 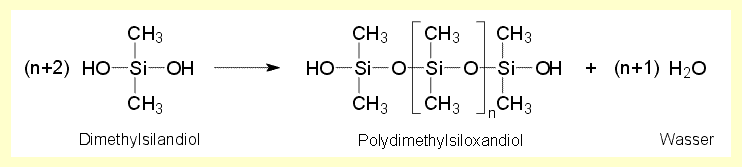 Methylsilantriol, das Hydrolyseprodukt von Trichlormethylsilan, kondensiert sehr schnell zu stark vernetzten Silicon-Makromolekülen. |
||||
|
||||
| Diese Versuche ergänzen die im unten angegebenen Lehrbuch dargestellten Inhalte zur nucleophilen Substitution, zur Polykondensation und zur technischen Herstellung von Siliconen. | ||||
| M. Tausch, M. von Wachtendonk (Hrsg.), CHEMIE S II, STOFF-FORMEL-UMWELT, C.C. Buchner, Bamberg (1993), (1998), S. 337f., S. 345f., S. 340 | ||||
