 |
1. Experiment ist im WACKER-Schulversuchskoffer enthalten |
nein |
2. Versuchsvorschrift wurde modifiziert |
/ |
3. Eigene Versuchsvorschrift wurde entwickelt |
ja |
4. Video-Clip verfügbar |
nein |
5. Flash-Animation verfügbar |
nein |
6. Weitere Materialien: Folie
B4 |
|
 |
Darstellung von Tetrachlorsilan |
 |
  1
Materialien, Chemikalien, Zeitbedarf 1
Materialien, Chemikalien, Zeitbedarf |
 |
- 2 Stative mit Querverbindungsstange
- Stativklammern und Muffen
- dickwandiges Reaktionsrohr
- Gleichdruckgasentwickler (oder Tropftrichter mit Druckausgleich, Stopfen,
kleiner Zweihalsrundkolben)
- 3 Reagenzgläser mit seitlichem Ansatz
- 2 Waschflaschen
- Liebigkühler (mit gut reinigbarem Innenrohr) und Schläuche
- hohes großes Becherglas
- Dreiwegehahn
- durchbohrte Gummistopfen
- gewinkelte Glasrohre (siehe Skizze)
- gerade Glasverbindungsrohre
- Schlauchverbindungsstücke
- Magnesiarinne oder Porzellanschiffchen
- Teclubrenner
- konz. Salzsäure, w = 37 %, C
- konz. Schwefelsäure, w = 98 %, C
- Natronlauge, w = 30 %, C
- Kaliumpermanganat, O, Xn
- Siliciumpulver
- Natriumchlorid für Eis-Kältemischung
- Natriumhydrogensulfit, Xi
Dieser Versuch benötigt viel Zeit. Insgesamt kann
mit 1,5 bis 2 Stunden für einen einzelnen Durchgang gerechnet werden.
Allein der Aufbau der Apparatur bedarf je nach Erfahrung und nach Passgenauigkeit
der Glasgeräte zwischen 30 und 60 Minuten. Der eigentliche Versuch
läuft etwa 20 bis 30 Minuten. Für den Abbau und die Reinigung
der Geräte sind ebenfalls etwa 30 Minuten anzusetzen. |
 |
  2
Versuchsdurchführung und -beobachtung 2
Versuchsdurchführung und -beobachtung |
 |
Da mit Chlor gearbeitet wird, ist
der Versuch unter dem Abzug durchzuführen. Das erste Spülen der
Geräte sollte ebenfalls im Abzug ausgeführt werden.
Schutzbrille, Gummihandschuhe und Laborkittel verstehen sich von selbst.
Der Versuch wird gemäß der folgenden Skizze aufgebaut: |
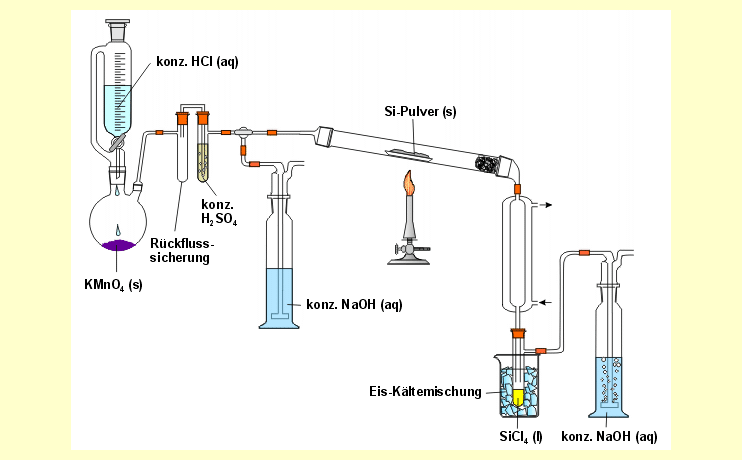 |
  In
den Rundkolben werden ca. 5 g Kaliumpermanganat gegeben und in den Tropftrichter
40 ml konzentrierte Salzsäure. Die konzentrierte Schwefelsäure
zum Trocknen des Chlorgases und die Natronlauge zur Chlorabsorption werden
eingefüllt. Das amorphe Siliciumpulver wird in einem Porzellanschiffchen
oder in einer Magnesiarinne in die Mitte des Reaktionsrohres platziert. In
den Rundkolben werden ca. 5 g Kaliumpermanganat gegeben und in den Tropftrichter
40 ml konzentrierte Salzsäure. Die konzentrierte Schwefelsäure
zum Trocknen des Chlorgases und die Natronlauge zur Chlorabsorption werden
eingefüllt. Das amorphe Siliciumpulver wird in einem Porzellanschiffchen
oder in einer Magnesiarinne in die Mitte des Reaktionsrohres platziert.
Dann wird die Apparatur komplett zusammengebaut und auf Dichtigkeit geprüft,
indem über den Dreiwegehahn der Gasentwickler mit dem Reaktionsrohr
verbunden und der Kolben mit der Hand angewärmt wird. In der zweiten
Waschflasche muss sich ein Druckunterschied bemerkbar machen.
Die Vorlage wird mit einer Kältemischung gekühlt und das Kühlwasser
angestellt. Nun wird der Dreiwegehahn vom Gasentwickler in die Richtung
zur ersten Waschflasche gestellt und langsam Salzsäure auf das Kaliumpermanganat
getropft. Hat sich eine gleichmäßige Chlorgasentwicklung eingestellt,
wird der Dreiwegehahn umgestellt und der Rest der Apparatur zunächst
mit Chlor gespült, bevor das Reaktionsrohr mit dem Teclubrenner zunächst
sanft, dann kräftig im Bereich des Siliciums erhitzt wird. Hat sich
in der Vorlage 0,5 bis 1 ml Produkt gesammelt, wird das Reaktionsrohr zunächst
im Chlorgasstrom abkühlt. Dann wird der Dreiwegehahn wieder zur ersten
Waschflasche gestellt. Nun kann die Vorlage entfernt und das Produkt weiter
verwendet werden.
Beim Zutropfen der Salzsäure auf das Kaliumpermanganat beobachtet
man, wie sich zunächst stoßweise mit jedem Tropfen grünliches
Chlorgas entwickelt. Nach ca. 1 min ist die Gasentwicklung gleichmäßig,
was gut an den in der Schwefelsäure aufsteigenden Bläschen zu
erkennen ist.
Beim Erhitzen im Chlorgas-Strom glüht das Siliciumpulver in der Magnesiarinne
nach längerem starken Erhitzen an der Seite zum Gasentwickler hin
in einer schmalen Linie hell auf. Die Glutfront wandert langsam mit dem
Gasstrom. Dabei entsteht im Rohr hinter dem Silicium weißer Rauch,
der sich im hinteren Teil des Reaktionsrohres zu einem gelben bis orangen
Belag niederschlägt. Im oberen Bereich des Liebigkühlers ist
eine klare Kondensbildung zu erkennen. In der Vorlage sammelt sich langsam
eine gelb-orange Flüssigkeit. Während dieser Reaktion ist in
der Waschflasche am Ende der Apparatur keine Bläschenbildung zu erkennen.
Die Wärmezufuhr wird bei einer Produktmenge von etwa 0,5 ml beendet.
Dabei ist recht schnell keine Rauchbildung mehr erkennbar. Danach lässt
sich, wiederum nach kurzer Zeit, eine kleine Bläschenbildung in der
Waschflasche erkennen. Ist das Reaktionsrohr weitgehend abgekühlt,
so dass damit hantiert werden kann, wird die Zufuhr von Salzsäure
abgestellt und das Chlorgas in die erste Waschflasche eingeleitet. Nachdem
die Chlorgasentwicklung aufgehört hat, wird die Apparatur im Abzug
geöffnet und für 1h im Abzug liegen gelassen. Anschließend
wird sie gereinigt.
Das Tetrachlorsilan wird weiter verwendet (siehe dazu den Versuch "Hydrolyse
von Tetrachlorsilan"). |
 |
  3
Versuchsauswertung 3
Versuchsauswertung
|
 |
Bei hoher Temperatur reagiert Silicium mit
Chlor unter Bildung von Tetrachlorsilan:

Es handelt sich hierbei um eine Redox-Reaktion, bei der Silicium durch Chlor
oxidiert wird.
Obwohl die Reaktion exotherm ist, läuft sie nur bei hoher Temperatur
schnell ab. Da im Experiment nur eine relativ geringe Menge Silicium eingesetzt
wird, reicht die Reaktionswärme der gestarteten Reaktion nicht aus,
um sie in Gang zu halten. Daher muss während der Reaktion von Chlor
mit Silicium ständig mit dem Brenner weiter erhitzt werden.
Die eingesetzte Siliciumprobe wird nicht vollständig umgesetzt, sie
verändert sich durch die Reaktion aber optisch sehr deutlich. Die folgenden
Mikroskopaufnahmen zeigen die Probe vor und nach dem Einsatz in diesem Versuch:

Die Masse des festen Edukts nimmt bei der Reaktion mit Chlor um einige hundert
Milligramm ab. Eine exakte quantitative Betrachtung macht bei diesem Versuch
wenig Sinn, denn erstens ist die Massenänderung zu gering und zweitens
enthält die eingesetzte Siliciumprobe in der Regel noch Spuren von
Aluminium und Eisen, die ebenfalls mit Chlor reagieren. |
 |
 |
Die dabei gebildeten Chloride AlCl3 und FeCl3 schlagen sich größtenteils als relativ
leicht sublimierbarer, gelber (reines Aluminiumchlorid) meist aber
oranger (durch Eisenchlorid verunreinigtes Aluminiumchlorid) Feststoff
an der Reaktionsrohr- oder Kühlerwand nieder.
Das im reinen Zustand wasserklare, flüssige Tetrachlorsilan wird
in diesem Versuch wegen der genannten Verunreinigungen als gelbe bis
orange Flüssigkeit erhalten. Das im Foto abgebildete Reaktionsprodukt
zeigt eine recht stark verunreinigte Probe aus Tetrachlorsilan. |
 |
|
 |
  4
Tipps und Anmerkungen 4
Tipps und Anmerkungen
|
 |
- Wird kein Liebigkühler eingebaut, so kann es relativ leicht geschehen,
dass die Kühlleistung der Eis-Kältemischung nicht ausreicht
und das Produkt in die Waschflasche getrieben wird. Dort bildet sich
dann an der Oberfläche der Natronlauge ein schaumiger Belag. Bei
einem sehr schwachen Chlorgasstrom geschieht das nicht, doch ist dieser
sehr schlecht einzustellen.
- Das Übertreiben des Belages am Reaktionsrohr ist möglichst
zu vermeiden, da so nur das Produkt weiter verunreinigt würde.
- Ein größerer Innendurchmesser des Liebigkühlers erleichtert
das Reinigen mit einer Bürste, ist doch ein Teil des sich dort
ablagernden Belages nicht sofort wasserlöslich. Die Kühlleistung
eines solchen Kühlers reicht dennoch aus, denn es werden in der
Waschflasche keine gegenteiligen Beobachtungen gemacht.
- Die Reinigung des Gasentwicklers von Braunstein gelingt leicht mit
einer schwach sauren, stark verdünnten Natriumhydrogensulfit-Lösung.
Da dabei Schwefeldioxid entsteht, empfiehlt es sich dringend, diese
Arbeit im Abzug auszuführen.
- In der unten angegebenen Literatur ist dieser Versuch
als Lehrerversuch in die Unterrichtseinheit "Herstellung und Eigenschaften
von Silicium" integriert.
|
 |
  5
Ergänzende Sachinformationen 5
Ergänzende Sachinformationen
|
 |
Am Beispiel von Tetrachlorsilan wird deutlich,
dass Silicium eine Zwischenstellung zwischen Metallen und Nichtmetallen
einnimmt.
Einerseits ist Tetrachlorsilan kein typisches Salz wie die Metallchloride,
sondern eine Flüssigkeit ähnlich wie Kohlenstofftetrachlorid,
also ein Chlorid des typischen Nichtmetalls Kohlenstoff. Andererseits aber
verhält sich Siliciumtetrachlorid gegenüber Wasser nicht wie Kohlenstofftetrachlorid,
sondern es reagiert mit Wasser wie die Metallchloride SnCl4 und
AlCl3 (vgl. dazu den Versuch "Hydrolyse
von Tetrachlorsilan"). |
 |
  6 Literatur 6 Literatur |
 |
| M. Tausch, M. von Wachtendonk (Hrsg.), CHEMIE
S II, STOFF-FORMEL-UMWELT, C.C. Buchner, Bamberg (1993), (1998), S. 357f |
 |
  | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | | Home | Uni Wuppertal | WACKER | Didaktik | Sachinfo | Versuche | Medien | Kontakt | |
|


